Белобородова Н.В. Курчавов В.А. Бойко Н.Б. Минаев В.А.
Демина А.М. Поздоровкина В.В. Кульганек В.В. Осипов Г.А.
Бирюков А.В. Титкова Н.Ф. Ходорковская В.А. Радюшина Т.В.
Рогатина Е.Л.
В В Е Д Е Н И Е
Современная клиническая медицина предъявляет все
возрастающие требования к комплексу лабораторных исследований,
применяемых для диагностики и лечения гнойно-воспалительных
заболеваний. Ввиду сложности бактериологических методик
выделения и идентификации анаэробов, отсутствия коммерческих,
специальных, питательных сред и надежной анаэробной техники,
исследования на анаэробы в обычных клинических лабораториях
страны еще недостаточно налажены. Между тем, для выбора
адекватных антибактериальных агентов и эффективного лечения
гнойных инфекций, требуется быстрое определение возбудителя и
его надежная идентификация. Наряду с трудоемкой, длительной и
сложной бактериологической диагностикой, существуют
нетрадиционные приемы зкспресс-диагностики анаэробов. В стадии
изучения находятся характеристики иммунофлуоресцентного,
иммунопероксидазного, радиоиммунного и метода встречного
электрофореза.
Ведущим методом экспресс-диагностики
анаэробной инфекции является метод газовой хроматографии
(ГЖХ-анализ). Ценность хроматографических методов для научных
исследований в области микробиологии и медицины в настоящее
время общепризнанна. Однако внедрение ее в медицинскую
практику пока еще сдерживается отсутствием простых и надежных
методик, пригодных для использования в условиях клинических
лабораторий.
Основными преимуществами метода являются:
-быстрота выполнения исследования (30-40 мин);
-высокая информативность (ориентировочная идентификация
возбудителя по спектру до рода и вида);
-высокая
чувствительность (10--6 г/л);
-возможность
проведения исследования биологических жидкостей организма при
труднодоступной локализации патологического очага;
-возможность контроля эффективности лечения
В
данных рекомендациях использован метод газохроматографического
анализа, позволяющий провести исследование химического состава
среды на содержание летучих жирных кислот, дикарбоновых и
фенилзамещенных кислот, после роста различных анаэробных
микроорганизмов. Полученные данные по химическому составу
культуральных сред могут быть использованы как дополнительный
тест при лабораторной диагностике анаэробной инфекции и в
качестве таксономического теста микроорганизмов.
Приводится методика определения диагностически
значимых летучих жирных кислот в биологическом материале
хирургических больных и варианты ее использования в педиатрии,
в частности, в детской хирургии. Особенно актуально применение
данного экспресс-метода в случаях, требующих срочного
хирургического вмешательства.
ОПИСАНИЕ
МЕТОДА
ФОРМУЛА МЕТОДА
Предлагается
стандартная экспресс-методика для дифференциации различных
видов монокультур анаэробов на основании данных ГЖХ-анализа
продуктов их жизнедеятельности. Культивирование проводилось на
пептонно-дрожжевой среде, которая дает возможность получить
достоверные информативные компоненты. В данной методике помимо
известных продуктов метаболизма - летучие жирные кислоты
(ЛЖК), нелетучие жирные кислоты (НЭЖК) используются
дополнительные информативные компоненты (ароматические
кислоты, амины) .Систематизированы данные по следующим
представителям анаэробной микрофлоры:
Вacteroides
fragilis,*
Bacteroides intermedius,
Bacteroides ovatus,
Bacteroides
asaccharolyticus,
Bacteroides melaninogenicus,
Bacteroides bivius,
Bactreroides vulgatus,
Bacteroides tretaiotaomicron,
Clostridium
perfringens,
Clostridium histolyticum,
Clostridium novui,
Clostridium septicum
|
Propionbacterium
acnes,
Fusobacterium nucleatum,
Fusobacterium necrophorum,
Peptostreptococcus spp.,
Bifidobacterium
adcfescenti,
Lactobacillus auid,
Veillionella parvula
| |
*
Изучаемые культуры были получены из ГИСК им.Л.А.Тарасевича и
ЦНИИЭ.
Впервые определены фоновые концентрации ЛЖК в
биологических средах у детей.
Доказана более высокая
информативность выявления ЛЖК из биологических сред при
хирургических заболеваниях у детей, протекающих с участием
неспорообразующей анаэробной микрофлоры, по сравнению с
традиционными методами лабораторной диагностики.
Предложено использование нового теста для
экспресс-диагностики инфекций, протекающих с участием
анаэробов любой локализации у детей, косвенно, путем
определения концентрации ЛЖК в моче методом газовой
хроматографии.
МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ
ОБЕСПЕЧЕНИЕ МЕТОДА
МАТЕРИАЛЫ ИССЛЕДОВАНИЯ
1.1. Материалы для идентификации монокультур
анаэробов
Культуры, выделенные из клинического
материала, культивируют в течение 48 часов на
пептонно-дрожжевой среде следующего состава:
пептон- 20,0 г
дрожжевой экстракт-20,0 г
солевой раствор-
40,0 г
цистеин гидрохлорид - 0,5
резорцина
раствор- 4,0мл
вода- 1000,0мл
РН среды-
7,2 |
Солевой раствор
имеет следующий состав: CаCl2- 0,2г
MgSO4-0,2г
К2HPO4-1,0 г
КH2PO4- 1,0 г
NaHCO3 -
10,0 г
NaCl - 2,0 г
| |
Образцы
культур клостридий были выращены также на бульоне Вейнберга
при температуре 37°С в течение 18-24 часов. На анализ брали
надосадочную жидкость после центрифугирования .
1.2.Материалы для диагностики инфекции, протекающей
с участием анаэробов в биологических жидкостях пациента
Материалом исследования больных с “острым животом”
служит содержимое брюшной полости (полученное при
лапароскопическом методе исследования или во время операции),
венозная кровь и / или моча.
У больных с остеомиелитом
исследовали кровь, пункционный и операционный материал,
полученный при открытой биопсии и / или мочу.
У
урологических больных исследуют венозную кровь, мочу и
содержимое дренажных трубок.
У новорожденных с
аспирационной пневмонией исследуют трахео-бронхиальный
экссудат, при септических состояниях - кровь.
Забор
мочи производится перед операцией в стерильную пробирку в
количестве 5 мл. Забор 1 мл венозной крови для исследования,
производится во время операции, у тех детей, которым требуется
инфузии лекарственных препаратов. Забор жидкости из брюшной
полости производится во время лапароскопии, у детей с
подозрением на острый аппендицит и абдоминальную форму
крипторхизма, с помощью отсоса в количестве 1-2 мл.
2. ГАЗОХРОМАТОГРАФИЧЕСКОЕ ОБОРУДОВАНИЕ И УСЛОВИЯ
АНАЛИЗА
2.1. Культуральные среды
Методические рекомендации отработаны на приборе
фирмы Hewlett Packard 5880 A c пламенно-ионизационным
детектором, капиллярной колонкой 1,6 м длиной и 2 мм
внутренним диаметром.
Колонка заполнена 10% АТ-1000+
1%H3PO4 на Сhromosorb W-AW/ 100-120mesh.
Раходы газов:
- газ-носитель - гелий- 60 мл/мин
- водород - 30 мл/мин
- воздух - 300 мл/мин
- Температура детектора -260°С
- Tемпература испарителя- 250°С
Температура
термостата колонок изменялась в режиме программирования
температуры от 80°С до 210 °С со скоростью 5° /мин.
Для ГЖХ-анализа также может быть использован любой
другой газовый хроматограф, имеющий близкие технические
характеристики.
2.2. Биологические жидкости
ГХ-определение проводили на хроматографе серии
GC-14 A фирмы “Shimadzu, с пламенно-ионизационным детектором и
кварцевой капиллярной колонкой FFAP длиной 25м с внутренним
диаметром 0,2 мм в изотермическом режиме (150° С ).
Раходы газов:
- газ-носитель - гелий- 1 мл/мин
- водород - 30 мл/мин
- воздух - 300 мл/мин
- Температура детектора -250°С
Для ГЖХ анализа
также может быть использован любой другой газовый хроматограф,
имеющий близкие технические характеристики. Появились новые
газовые хроматографы фирмы Agilent Technology (бывшая Hewlett
Packard), например, АТ-5990A.
3. СТАНДАРТНЫЕ СМЕСИ
КИСЛОТ
Для идентификации компонентов использовали
стандартную смесь (10 мМоль каждого компанента в 100 мл
водного раствора)
Таблица 1.
Стандартная смесь
летучих кислот /ЛЖК/
| Название кислоты
|
Содержание кислоты,
мг в 100мл водного раствора |
| уксусная |
600.5 |
| пропионовая |
740.8 |
| изомасляная |
881.0 |
| масляная |
881.0 |
| изовалериановая |
1021.3 |
| валериановая |
1021.3 |
| изокапроновая |
1161.6 |
| капроновая |
1161.6 |
| гептановая |
1301.9
| |
Для
получения колибровочной смеси разбавляли стандартную смесь до
концентрации 0.4 мкМоль/мл. Для анализа отбирали 1 мл смеси,
добавляли 40 мкл (2 капли) 50% Н2SO4 и 1
мл серного эфира. Смесь герметично закрывали и энергично
встряхивали. После разделения слоев, верхний эфирный слой
отбирали в чистую пробирку. Экстракцию проводили дважды. Затем
упаривали эфир до объёма 100 мкл. Для ГЖХ анализа отбирали 1
мкл эфирного экстракта. Хроматограмма стандартной смеси
летучих кислот показана на рис.1.
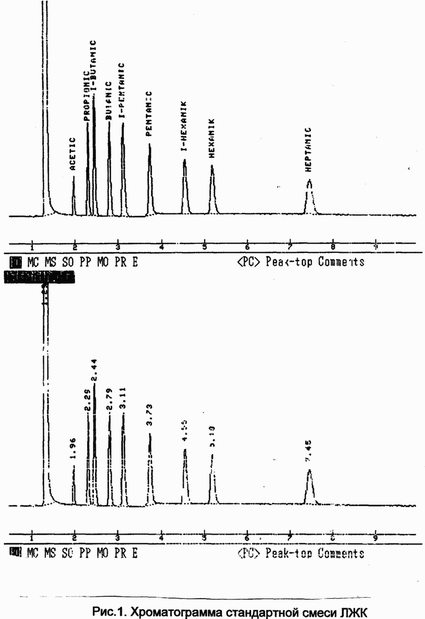 |
| Рис.1
|
Таблица 2.
Стандартная
смесь нелетучих кислот /НЖК/.
| Название кислоты
|
Содержание
кислоты,мг в 100 мл водного раствора |
| пировиноградная |
88,06 |
| молочная |
90,08 |
| щавелевоуксусная
|
66,04 |
| щавелевая |
45,02 |
| метилмалоновая |
59,05 |
| малоновая |
52,03 |
| фумаровая |
58,04 |
| янтарная |
59,05
| |
Для
получения метиловых эфиров отбирали 1 мл стандартной смеси,
добавляли 0,4 мл 50% Н2SO4 и 2 мл
метанола. Прбирки плотно закрывали и нагревали 30 мин при 60
°С. К смеси, после охлаждения до комнатной температуры,
добавляли 0,5 мл хлороформа и 1 мл дистиллированной воды.
Нижний слой хлороформа отбирали в чистую пробирку. Для
ГХ-анализа отбирали 5 мкл хлороформенного экстракта.
4. Подготовка пробы к анализу
4.1.Анализ
летучих кислот культуральной среды
В продуктах
метаболизма определяли следующие летучие кислоты:
- уксусная,
- пропионовая
- изо-масляная
- масляная,
- изовалериановая
- изокапроновая
- капроновая
- энантовая
2 мл культуральной среды после
отделения выращенной культуры помещали в пробирку, добавляли
0,2 мл 50% H2SO4, 0,4 г NaCl и 1 мл
серного эфира. Пробирку тщательно закрывали и энергично
встряхивали. После разделения слоев центрифугированием, в
чистую пробирку отбирали верхний эфирный слой.
В
газовый хроматограф вводили 5...10 мкл эфирного экстракта.
Идентификацию пиков на полученных хроматограммах проводили
путем сравнения времен удерживания стандартной смеси летучих
кислот и исследуемых смесей.
4.2.Анализ нелетучих
жирных кислот культуральной среды
В продуктах
метаболизма определяли следующие нелетучие кислоты:
- молочная
- щавелевоуксусная
- щавелевая
- метилмалоновая
- малоновая
- фумаровая
- янтарная
- пировиноградная
- фенилуксусная
- фенилпропионовая
Нелетучие жирные кислоты
анализировали в виде их метиловых эфиров. Для получения
метиловых эфиров нелетучих жирных кислот в пробирку отбирали 1
мл культуральной жидкости, добавляли 0,4 мл 50%
H2SO4 и 2 мл метанола. Пробирки
герметично закрывали и нагревали 30 минут при 60° С.
После охлаждения в пробу добавляли 1 мл воды и 0,5 мл
хлороформа. Смесь энергично встряхивали.
Для хорошего
разделения слоев пробы центрифугировали 10 мин при 3000
об/мин. В чистую пробирку отбирали нижний слой хлороформа,
добавляли внутренний стандарт / раствор метилового эфира
ундекановой кислоты/. Пробу упаривали до объема 100 мкл. В
испаритель хроматографа вводили 5...10 мкл пробы. Для
идентификации метиловых эфиров нелетучих жирных кислот в
культуральных жидкостях их времена удерживания сравнивали с
временами удерживания компонентов стандартной смеси.
4.3. Анализ исследуемого биологического материала
на содержание ЛЖК
Полученный материал тщательно
гомогенизировали (1 мл пробы). При необходимости добавляли 1
мл физиологического раствора и центрифугировали 10 мин при
4000 об/мин . РН супернатанта доводили 50% серной кислотой до
2,0, проводили экстракцию эфиром - 2 раза по 1 мл. Полученный
эфирный экстракт упаривали до 100 мкл и вводили
непосредственно в хроматограф в количестве 1 мкл.
Идентификацию ЛЖК осуществляли по относительному времени
удерживания, для сравнения использовали аналитические
стандарты жирных кислот.
Количественное содержание ЛЖК
устанавливали при сравнении высот пиков на хроматограммах
пробы и стандартного раствора с известной (0,4мкмоль/мл)
концентрацией аутентичных кислот. Для полной достоверности
количественных результатов стандартный раствор
хроматографировали перед каждой серией анализов, выполняемых
последовательно при установившемся режиме работы прибора. При
исследовании клинического материала содержание кислот в пробе
определяли до 0,0001 мкмоль/мл. С целью учета полноты перехода
кислот из водной фазы в эфирную сравнивали хроматограммы
эфирного раствора концентрации 0,4 мкмоль/мл и эфирного
экстракта из 1мл водного раствора той же концентрации.
Установлено, что ЛЖК переходят из водной фазы в
эфирную не полностью, поэтому введены поправочные коэффициенты
(К), для установления истинного содержания кислот в образце:
К- для уксусной кислоты (С 2) -8 ; для пропионовой (С 3) ,
изомасляной (iC4),масляной(C4), изовалериановой (iC5)- 1,5;
для валериановой (С5), изокапроновой (iC6),капроновой (С6) -1.
Материал обработан с помощью статистического пакета
STATgraphics Vers 4.
5.ОЦЕНКА РЕЗУЛЬТАТОВ
ИССЛЕДОВАНИЙ
5.1. Культуральные среды.
В
контрольных образцах пептонно-дрожжевой среды обнаружены
уксусная ( до 10мкг/мл) и янтарная ( до 20 мкг/мл) кислоты.
Летучие и нелетучие кислоты, производимые различными видами
анаэробных микроорганизмов, представлены в табл.3. В настоящих
методических рекомендациях мы приводим также данные,
полученные нами ранее, по образованию летучих кислот и аминов
у клостридий в случае их роста на бульоне Вейнберга. В табл.4
представлены результаты хроматографического анализа,
отражающие видовую специфичность клостридий в продуцировании
кислот и аминов.
Таблица 3
Состав основных
кислотных компонентов в культуральных жидкостях после роста
анаэробных микроорганизмов на пептонно-дрожжевой среде
| Вид |
Основные летучие
кислоты |
Основные нелетучие
кислоты |
| Вacteroides
fragilis 323, |
A,P,IV |
S,L,PY |
| Bacteroides
intermedius,25611 |
P,A,IV |
S,L,PY |
| Bacteroides
ovatus,8483 |
A,P,IV |
S,PhA,L |
| Bacteroides
asaccharolyticus,9337 |
B,IV,P |
S,L |
| Bacteroides
melaningenicus,1011 |
P,A,IV |
S,L,M |
| Bacteroides
bivius,6318 |
P,A,IV |
S,L |
| Bactreroides
vulgatus,8482 |
P,A,IV |
S,PY,QA |
| Bacteroides
tretaiotaomicron,10582 |
A,P,IV |
S,L,PA |
| Clostridium
perfringens,28 A |
B,A |
S,L |
| Clostridium
histoliticum139 |
A |
S |
| Clostridium
novyi,66 A |
B,HCA,P |
S,HCA |
| Clostridium
septicum |
IV,B,PA |
S,L,PA |
| Propionbacterium
acnes,70 |
P,A |
S,M,Q |
| Fusobacterium
nucleatum,143 |
A,B |
S,QA,L |
| Fusobacterium
necrophorum 22 |
A,B,P |
S,QA |
| Peptostreptococcus
spp.172/174, |
IC,HCA,IV |
HCA,S,L |
| Bifidobacterium
adcfescenti |
A |
L |
| Lactobacillus auid
|
A |
L |
| Veillionella
parvula |
А,P |
|
| Пептонно-дрожжевая
среда |
А |
S
| |
Обозначения
кислот:
| A - уксусная |
P-пропионовая |
QA
-щавелевоуксусная |
| IV -
изовалериановая |
V -валериановая |
IC - изокапроновая
|
| Q - щавелевая |
B- масляная |
PY -
пировиноградная |
| PhA - фенилуксусная
|
S - янтарная |
M - малоновая
|
|
|
YCA -
гидрокоричная/фенилпропионовая
| |
Компоненты
в таблице перечислены в порядке уменьшения их содержания.
На рис.2 приведены хроматограммы летучих кислот и
метиловых эфиров нелетучих кислот, обнаруженных в
культуральных жидкостях после роста Вacteroides fragilis 323.
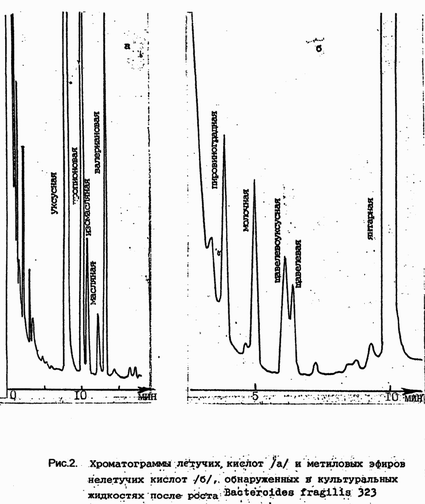 |
| Рис.2
|
Таблица 4
Состав
основных летучих кислот и аминов в культуральных жидкостях
эталонных видов клостридий, выращенных на бульоне Вейнберга
| Вид |
Основные летучие
кислоты |
основные амины
|
| Clostridium
perfringens, |
B,P,A |
Ph,His,Cad |
| Clostridium
histoliticum, |
A,B,P |
Put,Cad,His |
| Clostridium
oedematies |
,B,P,A |
Ph,Cad |
| Clostridium
septicum |
B,A,IV |
Cad,Put,His |
| Clostridium
sordelli |
HCA,IC,B |
|
| Clstridium
difficille |
IC,B,P |
| |
Обозначения
кислот приведены в табл.3
Обозначения аминов: Cad -
кадаверин,Put - путресцин,Нis - гистидин,Ph - фенилэтиламин
Компоненты в таблице перечислены в порядке уменьшения
их содержания
5.2. Биологический материал от
пациентов
При обнаружении гнойно- воспалительного
процесса у детей следует сравнить результаты исследования
патологического материала с данными табл.5.
Таблица 5.
Фоновые концентрации ЛЖК (мкмоль/мл) в биологических
средах у детей, не имеющих гнойно-воспалительных очагов
| Анализируемый
материал |
A |
P |
B, IB, V, IV, C,
IC |
| Трахео-бронхиальный
экссудат |
0 |
0 |
0 |
| Венозная кровь |
< 0,5 |
< 0,03 |
0 |
| Жидкость из брюшной
полости |
< 1,0 |
< 0,03 |
< 0,03 |
| Моча |
< 1,0 |
< 0,05 |
< 0,05
| |
Обозначения
кислот:
| A - уксусная |
P-пропионовая
|
| B- масляная |
IB- изомасляная
|
| V -валериановая |
IV -
изовалериановая |
| С-капроновая |
IC - изокапроновая
| |
Повышение
содержания ЛЖК в биологическом материале выше фоновых значений
свидетельствует о развитии инфекции с участием анаэробов.
Возрастание концентрации метаболитов анаэробных
бактерий в биологическом материале выше фоновых значений у
детей, поступивших с подозрением на острый аппендицит,
свидетельствует о гнойном процессе в брюшной полости.
Дополнительно подтверждающим фактором является
обнаружение ЛЖК в сыворотке крови, наряду с уксусной и
пропионовой кислотами. Показано, что при гангренозном
аппендиците уровни ЛЖК в биологических средах были существенно
выше, чем при флегмонозном аппендиците; для A,P,B,C -в
среднем в 2-3 раза, для IV, V в 6-26 раз.
Данный метод рекомендуется для косвенной диагностики
анаэробной инфекции у новорожденных, находящихся на
исскуственной вентиляции легких.
Данные обследования
/264 пациента/ показали повышенные концентрации пропионовой,
изомасляной, масляной и изовалериановой кислот в
трахеобронхиальном экссудате больных детей. При лечении
меронидазолом выявлено статистически достоверное снижение
уровня этих кислот.
На рис.3 приведены хроматограммы
ЛЖК в смыве из трахеобронхиального дерева ребенка Д.(6 дней
жизни) с пневманией на ИВЛ и ребенка К.(7дней жизни) без
пневмании.
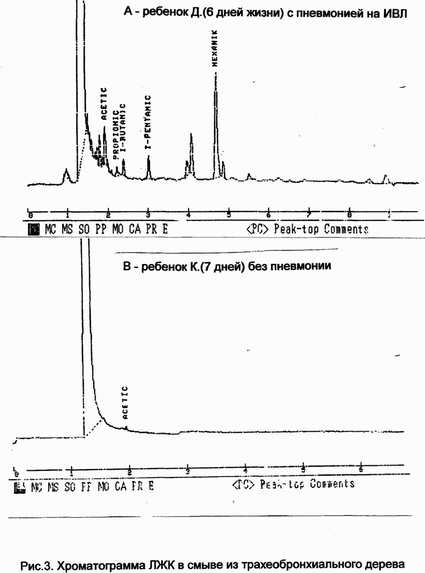 |
| Рис.3
|
Анаэробные бактерии
принимают активное участие в развитии воспалительного процесса
мочевыводящих путей у урологических больных, о чем
свидетельствует повышение ЛЖК в биологических средах у детей
выше фоновых концентраций с обострением хронического
пиелонефрита. При этом, метаболиты анаэробных бактерий
появляются раньше, чем некоторые лабораторные (лейкоцитоз,
СОЭ, лейкоцетурия) признаки.
В развитии острого
гематогенного остеомиелита у детей, наряду с золотистым
стафилококком может принимать участие и анаэробная флора, так
как в 50% случаев ЛЖК выше фоновых обнаружены в очаге
воспаления и в 60% - в моче.
По уровню метаболитов
анаэробных бактерий можно контролировать эффективность
проводимой терапии, так как стойкое снижение ЛЖК до фоновых
концентраций, свидетельствует о подавлении бактериальной
активности.
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К
ПРИМЕНЕНИЮ МЕТОДА
Ориентировочный перечень
отделений и групп больных, где возможно эффективное
использование предложенного экспресс-метода ГЖХ-диагностики
анаэробной инфекции, приведен в табл.6.
Таблица 6
Перечень отделений и патологий, при которых рекомендован
ГХ-метод анаэробной инфекции
| Отделения |
Заболевания |
| Отделения
интенсивной терапии новорожденных |
Асфиксия,
мекониальная аспирация Аспирационная пневмония на
ИВЛ Сепсис |
| Хирургические
отделения |
Раневая
неклостридиальная и клостридиальная инфекция
Перитониты, абсцессы брюшной полости и
забрюшинного пространства Паранефрит, абсцессы
почек Абсцессы печени Хронический остеомиелит
Хронические воспалительные процессы легких и
плевры |
| Отделения
гематологии и онкологии |
Гипертермия неясной
этиологии Сепсис, гнойно-воспалительные очаги
|
| Отделения
акушерства и гинекологии |
Эндометрит,
послеродовой сепсис |
| Отделения
неврологии нейрохирургии |
Абсцессы мозга
| |
Забор
материала у больных перечисленных групп осуществляется до
начала антибактериальной терапии или в течение первых суток от
момента ее применения. Последующий контроль эффективности
антибактериальной терапии осуществляется через 3-5 суток. В
тяжелых случаях число исследований определяется лечащим
врачом. Применение адекватной антибактериальной терапии
приводит к снижению содержания ЛЖК в биологических жидкостях
до фоновых концентраций. Противопоказаний к применению метода
не наблюдалось.
Ожидаемый эффект от внедрениЯ
Определение метаболитов анаэробов в
биологических средах у детей, можно использовать для
лабораторной диагностики хирургических инфекций, протекающих с
участием анаэробной микрофлоры.
Преимущество
ГЖХ-метода анализа заключается в скорости ответа (от момента
взятия сыворотки крови 0,5-1,0 часа, включая и организационные
расходы времени), специфичности и высокой чувствительности.
Клиническое внедрение метода в отделениях детской
онкогематологии позволило в течение двух лет снизить
летальность от осложнений, вызванных анаэробами в 2,7 раза.
Показано, что диагностическая значимость метода у
детей выше, чем у традиционных методов исследования.
Своевременная терапия значительно улучшает прогноз
заболевания и сокращает сроки лечения. Метод позволяет
использовать менее токсичные препараты благодаря возможности
контролировать эффективность терапии.
СПИСОК
ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Об унификации
микробиологических /бактериологических/ методов исследования,
применяяемых в клинико-диагностических лабораториях
лечебно-профилактических учреждений. - Приказ N 535 от
22.04.1985 г. Минздрав СССР, Москва, 1989 г.
2. Мitruka
B.M.// Gas cyromatographic applications in microbiology and
medicine. N.Y.,-1975 г.
3. Holdeman L.V., Moore W.E.C.
Anaerobe Laboratory Manual. // Blacksburg, Virginia Polytec.
Ins. and State Univ. Anaerobe Lab. 1972.
4. Шимчук Л.Ф.,
Демина А.М. Идентификация анаэробных спорообразующих бактерий,
выделенных от больных. Стандарты, штаммы и методы контроля
бактерийных и вирусных препаратов// Сб. научных трудов, ГИСК
им.Л.А. Тарасевича,М.,1989,с.15-21.
5. Методические
рекомендации по использованию хроматографических методов для
диагностики газовой гангрены. - ВНИИ БП, Москва, 1990 г.
6. Быченко Б.Д., Каплунова О.П., Кудрина Д.С.
Дифференциация основных видов клостридий методом газовой
хроматографии. // ЖМЭИ.- 1985, № 10.- С. 22-25.
7.Шимкевич
Л.Л., Истратов В.Г.Использовапние газожидкостной хроматографии
для изучения клостридиальной анаэробной инфекции в
хирургической клинике.//Лаб.дело,-1985,№ 4,с.225-227.
8.
Shan H.N., Collins G. //J. Appl.Bacteriology.-1983.-V.55-№
3.-P.403-416.
9.Meena Kudav et al. //
Ind.J.Clud.Res.-1983.-V.77-P.24-28
10. Smith Doug.//
Abstr.Ann.Meet.Amer.Soc.Microbiol.,-1987.-87th Ann. Meet.,
Atlanta, Ga, 1-6 March,1987.-Washington,D.C.-1987.-P.244
11. Uchida //Agr.Biol.Chem.-1975.-V.39,№ 4.-P.837-842.
12. Moss C.W. // J.Clin.Microbiol.-1977.-V.5,№
6.-P.665-667.
13. Luderitz O.//New
Acad.Press.-1971.-V.4,-P.145-161.
14.Васильева
А.В.//Биохимия и иммунология микробных
полисахаридов.-Томск,-1984.
15.Dahlen G. Ericsson
I.//J.Clin.Microbiol.-1983.-V.129,№ 3.-P/557-563.
16.
Отчет по этапу 1 договора ГосНИИ БП- ДЦГКБ им Н.Ф.Филатова №
20-92/17. Систематизация и обобщение данных по анаэробной и
грибковой инфекции. Выбор перспективных классов маркерных
соединений. - ВНИИ БП, Москва, 1992 г.
17.Brooks J.B.,Moss
C.W., Dowell V.R.// J.Bacteriol.-1969.-V.100,№ 1.-P.528-530/
18.Brooks J.B.,Moore W.E.C.//Canad. J.
Microbiol.-1969.-V.15.-P1433-1446.
19.Титкова
Н.Ф.,Сергеева Т.И.,Бабайцева В.А.,Чирикова Е.В. Заявка N
4915050/14 “Способ дифференциальной диагностики ведущих
возбудителей газовой гангрены”.
20. Осипов Г.А., Истратов
В.Г., Шабанова Е.А., Сергеева Т.И., Недорезова Т.П.,
Ходорковская В.А., Бабайцева В.А., Чирикова Е.В. Патент №
2021608 “Способ диагностики клостридиальной анаэробной газовой
инфекции”.
21.Aluyi H.S. //Y.Applied
Bacteriology.-1983.-V.54.-P.391-397.
22. Pritchard D.C. //
Y.Clin. Microbiol.-1981.-V.13.-P. 89-91.
|


