Актуальной проблемой здравоохранения является
совершенствование мер борьбы с внутрибольничными
гнойно-воспалительными заболеваниями (ГВЗ). Это связано с
высоким уровнем заболеваемости, тяжестью клинического течения,
многообразием агентов этой патологии. Так, в последние годы
наряду с ГВЗ, обусловленными стафилококками и
грамотрицательными бактериями, отмечается нарастание числа
госпитальных микозов, в первую очередь, кандидозов у
новорожденных. Особенно часто эти инфекции регистрируются
среди недоношенных детей. Дрожжеподобные грибы рода Candida
вызывают у них как поверхностные, так и висцеральные формы
заболевания, включая менингит и сепсис. Отсутствие клинических
признаков, специфичных для очаговой или генерализующейся
грибковой инфекции, отрицательные результаты посевов более чем
в половине случаев грибковых септицемий; затруднительная
интерпретация результатов культурального метода исследования,
не исключающая миконосительство при положительных посевах
отделяемого из зева, мокроты или фекалий - заставляют искать
иные подходы для современной диагностики инвазивного
кандидоза.
Рост вспышек этой патологии, особенно в
отделениях для недоношенных детей, требует разработки методики
экстренной диагностики грибковой инфекции с помощью
высокочувствительных, специфичных методов.
Для
диагностики грибковой инфекции в данных рекомендациях
использован газохроматографический метод анализа, позволяющий
провести комплексное исследование изменений химического
состава среды, в которой проявляется метаболическая активность
грибков, вызывающих кандидоз. Данный метод отличается высокой
чувствительностью, экспрессностью и хорошей возможностью для
автоматизации и стандартизации анализа.
В
исследованиях по поиску информативных компонентов клеточной
биомассы и продуктов жизнедеятельности использовались музейные
и выделенные от больных культуры грибковых микроорганизмов:
· род Candida: C.albicans, C.tropicalis,
C.pseudotropicalis, C.famata, C.stellatoidea, C.parapsilosis,
Candida sp.
· род Penicillum: P.frequentas,
P.terlicowskii, P.diversum
· род Fusarium:
F.oxysporum, F.moniforme, F.javanicum, Fusarium sp.
·
род Aspergillus: A.niger, A.fumigatus
· род
Alternaria: A.solanii, A.tenuis, A.sp.
· род Mucor:
M.racemosus, M.phusillus
прочие: Micromonospora
monospora, Nocardia asteroides, Geotrichum candidum,
Sporotrichum schenkii, Cryptococcus laurentii, Quidiodendrum
gracili.
Результаты исследований позволили выявить
специфичные для рода Candida соединения углеводного характера,
анализ которых в биологических жидкостях человека положен в
основу предлагаемого экспресс-метода диагностики кандидоза.
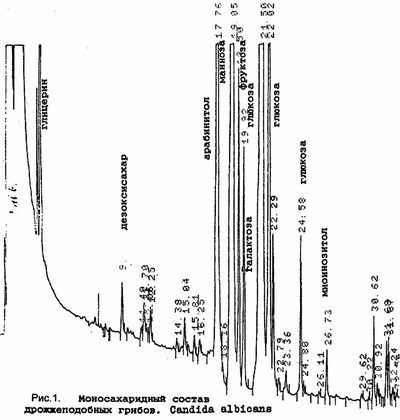
На рис.1 представлен моносахаридный состав
дрожжеподобных грибов Candida albicans.
 |
| Рис. 1
|
Методические рекомендации
могут быть использованы при диагностике грибковой инфекции в
клинических условиях, а также научно-исследовательских
учреждениях в целях изучения таксономии дрожжеподобных грибов.
В результате газохроматографических (ГХ)-исследований
продуктов жизнедеятельности и состава клеточной биомассы
различных грибов - возможных возбудителей грибковой инфекции -
были обнаружены информативные для рода Сandida соединения
углеводного характера. Эти же соединения выявлены в следующих
обьектах: культуральных жидкостях посевов эталонных видов
грибов, в сыворотке и ликворе пациентов с подозрением на
грибковый сепсис. Для подтверждения информативности
предполагаемых “маркерных” компонентов исследовались такие
биологические жидкости как сыворотка крови, ликвор пациентов с
подозрением на грибковую инфекцию. Диагноз грибковой инфекции
был подтвержден микробиологическими методами и результатами
аутопсии. Учтены также клинические проявления болезни, в
частности, положительная динамика в состоянии больного при
эмпирическом назначении противогрибковых препаратов. Целью
исследования являлось установление стандартного
хроматографического профиля биологической жидкости
контрольного пациента и пациента в остром периоде заболевания.
Для изучения было взято 100 контрольных и более 1000 больных
пациентов с подозрением на грибковую инфекцию. Для анализа
отбирались кровь и, в случае подозрения на менингит,
спинномозговая жидкость.
В результате проведенных
экспериментов в основу диагностики грибковой инфекции взят
метод газохроматографического определения содержания
арабинитола, маннозы и маннитола в биологических жидкостях
человека. Данные соединения определялись путем
модифицированной методики ГХ-определения углеводов.
Методика основана на применении метода капиллярной
газовой хроматографии, который позволяет разделить сложную
смесь углеводов, присутствующих в сыворотке крови и ликворе
человека. Для газохроматографического определения арабинитола,
маннозы и маннитола используют триметилсилильные производные
углеводов. Анализ состоит из следующих этапов:
·
осаждение белка;
· сушка надосадочной жидкости;
·
получение силильных производных углеводов;
· экстракция
силильных производных углеводов гексаном;
·
газохроматографический анализ силильных производных углеводов.
Подготовка пробы к анализу составляет 1,5...2 ч,
одновременно могут быть приготовлены 8...10 образцов.
Новизна методики заключается в применении реагента,
допускающего наличие влаги в образце,
N-триметилсилилимидазола, и концентрировании образца путем
экстракции гексаном.
Порог чувствительности методики
составляет 0,1 мкг/мл. Воспроизводимость анализа одного
образца при доверительной вероятности определения, равной
0,95, составляет 2...3%. Максимально допустимое значение
суммарной погрешности результата измерений DС=10...25%.
· Хроматограф газовый, серия GC-14 A фирмы “ Shimadzu”
или газовый хроматограф c аналогичными техническими
характеристиками. Хроматограф снабжен пламенно-ионизационным
детектором, блоком программирования температуры термостата от
60°С до 450°С , испарителем с температурой нагрева 60...450
°С, кварцевой капиллярной колонкой с метилсиликоновой
неподвижной фазой 25м х 0,25мм.
· Весы лабораторные
двухпризменные модели ВЛДП-100, ТУ 25-06-1391-77.
·
Центрифуга лабораторная медицинская ОПН-8.442, ТУ
5-375-4261-76.
· Термоблок /до 100 °С/ для пробирок
”Drybath” модель 17615 /США/ или баня водяная лабораторная
одноместная ТУ 46-22-587-80.
· Термометр ртутный
стеклянный ТЛ-7, ТУ 25-11-1388-77.
· Пипетки 4-1-2 и
8-2-0,1 ГОСТ 20292-74.
· Пикнометр ПЖ 2-25-КШ 7/16
ГОСТ 22524-77.
· Микрошприц “Газохром-101”, ТУ
25-05-2152-76.
· Cтеклянные центрифужные пробирки
объемом до 10 мл.
· Набор углеводов для
газохроматографической идентификации./фирма “Altech , США/.
· N-триметилсилилимидазол / “Serva”, ФРГ/, 37072.
· Ацетон,чда, ГОСТ 2603-79.
· Гексан, ч, ТУ
6-09-3375-78.
· Компрессор для получения сжатого
воздуха.
· Генератор водорода.
· Гелий
газообразный, ГОСТ 20461-75.
Предлагаемая методика
диагностики отработана на таких биологических жидкостях, как
сыворотка крови и ликвор (спинномозговая жидкость)
Для
анализа требуется 0.5 мл биологической жидкости. Отбор
исследуемого материала, как объекта для хроматографического
анализа следует вести согласно Приказу №535 от 22.04.85г.
Основные условия, которые должны быть соблюдены:
1. Кровь для получения сыворотки следует брать,
соблюдая правила асептики, для того, чтобы избежать попадания
микроорганизмов из внешней среды.
2. Анализ необходимо
проводить во время подъема температуры в начале появления
лихорадки.
3. Кровь для анализа следует брать до
начала специфического антибактериального химиотерапевтического
лечения, или, по крайней мере, через 12-24 часа после
последнего введения препарата больному (в зависимости от
скорости выведения примененного препарата из организма). Для
получения сыворотки стерильно взятую кровь в количестве 0.5-1
мл центрифугируют для осаждения форменных элементов крови в
течение 10 минут при 3000 об/мин.
4. Взятие
спинномозговой жидкости проводят как можно раньше, желательно
до начала антибактериального лечения. Взятие спинномозговой
жидкости проводит врач. Проба отбирается со строгим
соблюдением правил асептики. Свежевзятый ликвор из шприца без
иглы над спиртовкой вносят в стерильную пробирку. Ликвор для
исследования немедленно доставляют в лабораторию, где его
подвергают анализу.
Уровень арабинитола, маннозы и
маннитола определяют методом “внутреннего стандарта”. В
качестве “внутреннего стандарта” используют D-эритритол для
сыворотки и рамнозу для ликвора, которые добавляют в
анализируемый препарат. Содержание арабинитола определяют при
условиях, указанных ниже:
· температура окружающего
воздуха 15...35° С,
· давление 84,0...107,0 кПа/630...800
мм.рт.ст./,
· влажность 45...80%,
· напряжение
переменного тока питания /50 ± 1/Гц.
Анализ
выполняется на капиллярной кварцевой колонке. Объем дозы,
вводимой в хроматограф, 2 мкл. Эффективность
газохроматографического разделения должна быть не менее 3000
теоретических тарелок на метр /ГОСТ 17567-81/.
Анализ
необходимо проводить при условиях:
· начальная
температура колонки, °С
· конечная
температура колонки , °С
· скорость
программирования, °/мин
· температура
испарителя, °С
· температура детектора, °С
· расход газа-носителя азота, мл/мин
· расход сброса, мл/мин
· расход
сброса из-под прокладки, мл/мин
· расход
водорода, л/мин
расход воздуха, мл/мин
· шкала усилителя, А
· шкала
интегратора, В
· продолжительность
анализа, мин
|
100±5
200±5
5
200±10
255±10
1±0,1
40±5
1±0,1
30±5
300±50
10×10
1
30
| |
3.
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ИЗМЕРЕНИЙ
3.1. Пуск и
вывод хроматографа на рабочий режим проводить в соответствии с
техническим описанием и инструкцией по эксплуатации,
прилагаемых к прибору.
3.2. Подготовка раствора,
используемого в качестве “внутреннего стандарта’.
3.2.1. Подготовка “внутреннего стандарта” для
сыворотки крови.
Навеску /25±0.001/мг D-эритритола
растворяют в дистиллированной воде, доводя обьем раствора до
метки /пикнометр на 25 мл/. Полученный раствор в количестве
0,4 мл вносят в пикнометр обьемом 100мл, доводя обьем раствора
до метки дистиллированной водой. При этом получают раствор с
концентрацией 4,0 мкг/мл.
3.2.2. Подготовка
“внутреннего стандарта” для ликвора.
Навеску
/25±0,001/ мг рамнозы растворяют в дистиллированной воде,
доводя обьем раствора до метки /пикнометр на 25 мл/.
Полученный раствор в количестве 1 мл вносят в пикнометр
обьемом 100 мл, доводя обьем раствора до метки
дистиллированной водой. При этом получают раствор с
концентрацией 10 мкг/мл.
3.3. Подготовка пробы к
анализу.
Образец сыворотки крови или ликвора человека
в количестве 0,1 мл помещают в пробирку вместимостью 10 мл,
добавляют 0,1 мл раствора “внутреннего стандарта” и 0,4 мл
ацетона. Пробирку закрывают и энергично встряхивают. Выпавший
осадок белка, отделяют центрифугированием 3000 об/мин, 10 мин.
Надосадочную жидкость переносят в чистую виалу на 2 мл и
высушивают в термостате при 50 °С.
Силильные
производные получают следующим образом: к сухому остатку
добавляют 0,04 мл N-триметилсилилимидазола / ТСИМ/, виалу
герметично закрывают завинчивающейся крышкой, снабженной
тефлонированной резиновой прокладкой, энергично встряхивают и
нагревают в термоблоке в течение 15 мин при температуре 75 °С.
После охлаждения к реакционной смеси добавляют 0,05 мл гексана
и энергично встряхивают. Аликвоту гексанового экстракта /2 мкл
/ вводят в хроматограф.
3.4. Подготовка модельной
смеси
3.4.1. Растворы эритритола и рамнозы
/”внутренний стандарт”/,арабинитола , маннозы и маннитола в
количестве 0,2 мл и концентрации 10 мкг/мл высушивают и
подвергают описанной в разделе 3.3 процедуре силилирования.
Для определения параметров удерживания и поправочных
коэффициентов в испаритель хроматографа вводят /3±0,1/ мкл
гексанового экстракта каждого компонента. Определяют
последовательность выхода компонентов из колонки, отношение
неисправленных обьемов удерживания и поправочных коэффициентов
для арабинитола, маннозы, маннитола и рамнозы. Повторяют
аналогичные измерения для перечисленых выше углеводов в
концентрациях 1 , 2, 5 и 50 мкг/мл.
3.4.2. Определение
поправочных коэффициентов.
Поправочный коэффициент
определяют по формуле:
КХ=
Sст./ Sх
где
Kх - поправочный коэффициент для
анализируемого соединения арабинитола /маннозы или маннитола/;
Sст. - площадь пика
эритритола или рамнозы / “ внутренний стандарт”/, в абс. ед.
Площадь пика рамнозы берется по сумме двух изомеров
Sx- площадь пика арабинитола/маннозы
или маннитола/ в абс.ед.;
Полученные значения
градуировочных коэффициентов усредняют по разным
концентрациям.
Результаты представлены в таблице 1.
Таблица 1.
Средние значения поправочных
коэффициентов для искомых компонентов относительно эритритола
№ п/п
|
Наименование
компонента
|
Отношение обьемов
удерживания относительно эритритола
|
Средние значения
поправочных коэффициентов
|
1
|
D-эритритол
|
1,0
|
-
|
2
|
D-рамноза
|
1,1 и 1,3
|
1,0 ± 0,3
|
3
|
D-арабинитол
|
1,5
|
1,0 ± 0,1
|
4
|
D-манноза
|
1,8
|
1,0 ± 0,1
|
5
|
D-маннитол
|
2,1
|
1,0 ± 0,2
| |
4.
ВЫПОЛНЕНИЕ ИЗМЕРЕНИЙ
4.1. В испаритель газового
хроматографа вводят 2 мкл исследуемого образца
триметилсилильных производных углеводов. Интегратор
осуществляет автоматическую запись хроматограммы разделяемой
смеси с регистрацией времени удерживания компонентов и
автоматическую обработку результатов анализа с выдачей данных
углеводного состава смеси в процентах/%отн./. Пример
хроматограмм триметилсилильных производных углеводов сыворотки
крови и ликвора контрольных пациентов и пациентов с грибковым
сепсисом указаны на рис.1, 2 и 3.
4.2. При введении
эритритола или рамнозы в анализируемую пробу навеску пробы для
приготовления “ внутреннего стандарта” следует брать на
аналитических весах с погрешностью не более 0,0002г.
4.3. Количество хроматограмм при выполнении каждого
анализа должно быть не менее двух.
5. ВЫЧИСЛЕНИЕ
РЕЗУЛЬТАТА ИЗМЕРЕНИЯ
5.1. Концентрацию арабинитола
/ маннозы или маннитола/ вычисляют по формуле:
Сх = Сст..
Sх × Кх/
Sст. , мкг /мл, где Сх
- концентрация искомого компонента /арбинитола, маннозы
или маннитола /;
Сст.- концентрация
“внутреннего стандарта” эритритола или рамнозы в мкг/мл,
Sх - площадь пика искомого
компонента /арабинитола, маннозы или маннитола/ в абс.ед. или
% относительных,
Sст.- площадь пика
стандарта /эритритола или рамнозы/ в абс.ед. или в %
относительных,
Кх - поправочный
коэффициент для арабинитола / маннозы, маннитола/.
5.2. Результаты измерений представляют в виде указания
концентрации арабинитола / маннозы и маннитола / в мкг/мл и
предельной погрешности найденного значения.
5.3.
Погрешность измерения содержания арабинитола/ маннозы и
маннитола/ в смеси вычисляется в соответствии с ГОСТ
12.1.016-79.
6.ОЦЕНКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
В виде силильных производных в сыворотке крови методом
ГХ определяется 10 углеводных компонентов (альдозы, кетозы и
полиолы). Качественный состав углеводов сыворотки крови:
арабинитол, рибитол, манноза, фруктоза, ангидроглюцитол,
галактоза, глюкоза, маннитол, глюцитол и миоинозитол (табл.2).
Качественный состав спинномозговой жидкости ( табл.3)
показал наличие таких углеводов как эритритол, арабинитол,
рибитол, манноза, фруктоза, ангидроглюцитол, глюкоза,
маннитол, глюцитол, миоинозитол. В качестве внутреннего
стандарта применять эритритол при количественном обсчете
углеводов ликвора не представляется возможным, поэтому обсчет
компонентов ликвора ведется по рамнозе, которая вводится в
ликвор в качестве внутреннего стандарта. Необходимо отметить,
что этот углевод дает при силилировании 2 изомера, поэтому при
обсчете площадь 2-х пиков суммируется.
Таблица 2.
Сравнительное содержание углеводов сыворотки крови
контрольного и больного пациентов в мкг/мл.
Углеводы
|
Контроль
|
Грибковая
инфекция
|
Арабинитол*
|
0.2 ¸ 0.5
|
>0.5
|
Рибитол*
|
0.3 ¸ 0.5
|
>0.5
|
Cумма:арабинитол
рибитол
|
0.5 ¸ 1.0
|
1.0 ¸ 10
|
Манноза*
|
5 ¸ 30
|
30 ¸ 150
|
Фруктоза*
|
5 ¸ 30
|
30 ¸ 200
|
Сумма: манноза
фруктоза
|
10 ¸ 60
|
>60
|
Aнгидроглюцитол
|
10 ¸ 30
|
10 ¸ 30
|
Галактоза
|
5 ¸ 60
|
5 ¸ 60
|
Глюкоза
|
300 ¸ 1000
|
300 ¸ 1000
|
Маннитол*
|
0 ¸ 0.5
|
>0.5
|
Глюцитол*
|
5 ¸ 10
|
5 ¸ 10
|
Cумма: маннитол
глюцитол
|
5 ¸ 11
|
>11
|
Миоинозитол
|
5 ¸ 10
|
5 ¸ 10
| | Условные
обозначения: *-трудноразделяемые компоненты
Сравнительные данные количественного анализа углеводов
ликвора показывают достоверную возможность диагносцировать
менингит, вызванный грибами C.albicans по содержанию тех же
информативных углеводов: арабинитол, манноза и маннитол (
табл. 3 ).
Таблица 3.
Сравнительные данные
содержания углеводов ликвора контрольного и больного пациента
в мкг/мл.
Углеводы
|
контроль
|
грибковая
инфекция
|
эритритол
|
5¸10
|
5¸10
|
арабинитол *
|
2¸6
|
> 6
|
рибитол*
|
2¸6
|
> 6
|
Сумма :арабинитол
рибитол
|
4 ¸ 12
|
>12
|
манноза *
|
10¸15
|
>15
|
фруктоза *
|
25¸35
|
>35
|
Cумма : манноза
фруктоза
|
35¸50
|
>50
|
ангидроглюцитол
|
10¸30
|
10¸30
|
глюкоза
|
500¸800
|
500¸800
|
маннитол *
|
0¸2
|
>2
|
глюцитол *
|
10¸15
|
>15
|
Cумма: маннитол
глюцитол
|
10¸17
|
>17
|
миоинозитол
|
30¸50
|
30¸50
| |
Условные
обозначения:
*- хроматографически трудноразделяемые
компоненты
Необходимо отметить, что хорошее разделение
компонентов достигается не всегда, поэтому в случае
трудноразделяемых веществ можно вести обсчет по сумме.
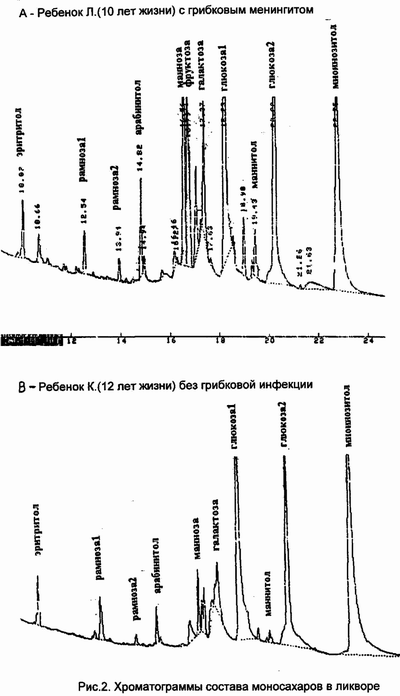
На рис.2 приведены хроматограммы состава моносахаров в
ликворе у ребенка Л.(10 лет жизни) с грибковым менингитом и у
ребенка К.(12 лет жизни) без грибковой инфекции.
 |
| Рис. 2
|
Оценивая полученные
данные, можно сказать следующее: превышение заданных
концентраций арабинитола, маннозы или маннитола относительно
нормального уровня свидетельствует о наличии грибковой
инфекции у больного.
7. СТАТИСТИЧЕСКИЕ ОЦЕНКИ
МЕТОДА. ЛОЖНО-ПОЛОЖИТЕЛЬНЫЕ И ЛОЖНО-ОТРИЦАТЕЛЬНЫЕ
РЕЗУЛЬТАТЫ
Порог чувствительности метода
составляет 0.1 мкг/мл. Воспроизводимость анализа одного
образца при доверительной вероятности определения, равной
0.95, составляет 2-3 %. Максимально допустимое значение
суммарной погрешности результата измерений С=10-25%.
Корреляция метода с клиническими данными 80-90% ( при
микробиологическом исследовании высев грибов Candida из
гемокультуры наблюдался лишь в 40-50% случаев грибковых
септицемий).
Ложно-отрицательные результаты
корректируются оценкой содержания одновременно 3-х компонентов
(арабинитола, маннозы и маннитола). Низкий уровень арабинитола
в крови больного кандидозом может быть связан с тем, что забор
крови произведен на фоне системной противогрибковой терапии. В
этих случаях факт обнаружения высокого уровня маннозы и
маннитола, как продуктов распада клеточной стенки грибов, на
фоне терапии может трактоваться в пользу диагноза грибковой
инфекции.
Ложно-положительные результаты по
арабинитолу возможны в случае высокой почечной недостаточности
(завышенное значение креатинина). В этом случае следует
корректировать данные, вводя поправку на клиренс эндогенного
креатинина.
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К
ПРИМЕНЕНИЮ МЕТОДА
Ориентировочный перечень
отделений и групп больных, где возможно эффективное
использование предложенного экспресс-метода ГХ-диагностики
грибковой инфекции, приведен в табл.4
Таблица 4
Перечень отделений и патологий при которых
рекомендован ГХ- метод грибковои инфекции
Отделения
|
Заболевания
|
Отделения
интенсивной терапии новорожденных
|
Менингиты у
новорожденных
|
Хирургические
отделения
|
Паранефрит,
абсцессы почек
Абсцессы печени
Хронические воспалительные процессы легких
и плевры
|
Отделения
гематологии и онкологии
|
Врожденный
иммунодефицит
Нейтропения на фоне
иммунодепрессии
Нейтропения на фоне
облучения,
Гипертермия неясной этиологии
Диссеминированный кандидоз
Сепсис,
гнойно-воспалительные очаги
|
Отделения
неврологиии нейрохирургии
|
Менингиты
| |
Забор
материала у больных перечисленных групп осуществляется до
начала антифунгальной терапии или в течение первых суток от
момента ее применения. Последующий мониторинг эффективности
противогрибковой терапии осуществляется один раз в 7-10 дней.
В тяжелых случаях кратность забора увеличивается по усмотрению
врача. В плане возможности использования предлагаемого метода
в качестве мониторинга при лечении пациентов с грибковой
инфекцией можно привести следующие данные. При использовании
данного метода при лечении детей с онкогематическими
заболеваниями перед началом эмпирической терапии уровень
метаболитов составил:
арабинитол
|
2.0 ¸ 4.0 мкг/мл;
|
манноза
|
80 ¸ 130 мкг/мл;
|
маннитол
|
20 ¸ 50 мкг/мл.
| |
После
введения противогрибковых препаратов содержание метаболитов
снизилось:
арабинитол
|
0.7 ¸ 0.8 мкг/мл;
|
манноза
|
20 ¸ 30 мкг/мл;
|
маннитол
|
6 ¸ 10 мкг/мл.
| | Противопоказаний
к применению метода не наблюдалось.
Ожидаемый
эффект от внедрения
Основной вывод из
проанализированного материала - газохроматографическое
определение содержания углеводных показателей (арабинитола,
маннозы и маннитола) сыворотки крови и ликвора позволяет
следить за метаболической активностью грибов рода Candida,
контаминировавших больного на момент исследования, может быть
использовано для диагностики грибковой инфекции и в качестве
мониторинга за эффективностью противогрибковой терапии.
Преимущество ГХ- метода анализа заключается в скорости
ответа ( от момента взятия сыворотки крови 2-3 часа, включая и
организационные расходы времени) , специфичности и высокой
чувствительности.
Клиническое внедрение метода в
отделениях детской онкогематологии позволило в течение двух
лет снизить летальность от грибковых осложнений в 2,7 раза.
Показано, что диагностическая значимость метода у
детей с подозрением на грибковый менингит выше, чем у
традиционных методов исследования. В перспективе, согласно
результатам анализа, возможно использование данного метода для
дифференциальной диагностики кандидоносительства и
висцеральных форм кандидозной инфекции.
Своевременная
терапия значительно улучшает прогоз заболевания и сокращает
сроки лечения. Метод позволяет использовать менее токсичные
противогрибковые препараты благодаря возможности
контролировать эффективность терапии. |

