Аскорбиновая кислота и глюкоза в коррекции процессов Свободнорадикального окисления ( экспериментальное исследование. Часть II )
Тимен Л.Я.,1 Шерцингер А.Г.,2 Мачнева Т.В., 3 Варданян Э.С.,2 Трубицына И.Е.,4Чикунова Б.З.,4
Жигалова С.Б.,2 Ольховский П.А.,3 Протопопов Д.М., 3 Стоногин С.В.,1 Клебанов Г.И. 3
1Городская клиническая больница №20; 2Российский научный центр хирургии РАМН;
3Российский государственный медицинский университет; 4ЦНИИ гастроэнтерологии, Москва
Эндоскопический превентивный метаболический гемо- и гомеостаз (ЭПМГ), разработанный Л.Я. Тименым [1,2], в течение 12 лет успешно применяется нами для лечения и профилактики рецидивов язвенных гастродуоденальных кровотечений, осложненных тяжелой кровопотерей и геморрагическим шоком, а также при синдроме Mallory- Weiss, эрозивно-геморрагическом гастродуодените, мальформациях и портальной гипертензии [1,2,3,4]. Использование инъекционно-инфильтрационного способа введения препаратов с раздельным и последовательным поступлением 5%-10% растворов глюкозы и 5% раствора аскорбиновой кислоты , ключевых ингредиентов ЭПМГ, в подслизисто-мышечный слой зон поражения продемонстрировало высокий противорецидивный и репаративный эффект данного метода гемостаза при кровотечениях различной этиологии и позволило значительно снизить число летальных исходов [2]. В части I нашего исследования были изучены некоторые биофизические механизмы влияния растворов аскорбиновой кислоты и глюкозы на процессы СРО в экспериментальной модели ран [5]. При этом отмечена умеренно выраженная про- и антиоксидантная функция 5% раствора глюкозы, обусловленная индукцией собственной системы эндогенных антиоксидантов, а не СОД-активности. Кроме того, установлена ведущая роль 5% раствора аскорбиновой кислоты в формировании антиоксидантной защиты и стабилизации анти- и прооксидантных компонентов СРС. В соответствии с полученными результатами мы были вправе ожидать усиления анти- и прооксидантной активности параметров СРО в случае одновременного введения указанных веществ в поврежденные ткани. Это предположение и определило задачу настоящего исследования - изучить эффект совместного воздействия аскорбата и глюкозы на СРС при экспериментальном воспроизведении ран с целью разработки оптимального варианта выполнения ЭПМГ.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Индикация параметров СРС осуществлялась на прежней модели экспериментальных ран, создаваемых по методу Л.И.Слуцкого в области холки животных под эфирным наркозом [ 5 ].
На рану, диаметром 3,0см, одевалось тефлоновое кольцо, которое закрывалось полиэтиленовой пленкой и фиксировалось проволокой у основания (рис.1).
Рис.1 Экспериментальная модель раны
Исследования выполнены в трех группах беспородных крыс весом 300-350г: контрольной (8 крыс) и двух опытных (по 6 крыс). В опытных группах ежедневно, в течение 4-х суток под раневую поверхность вводили по 10мл смеси:5мл 5% раствора глюкозы и 5мл 5% раствора аскорбата. Раневой экссудат собирали через 2,3 и 4 суток после операции. Затем снимали кольца и, начиная с 4-х суток, изучали динамику заживления ран. На 6-е сутки с целью морфологической оценки качества заживления производили забор биоптатов из краев и дна сформированных ран. Для характеристики СРС определяли в экссудате СОД-активность в модификации Г.И. Клебанова и соавт. и функциональную активность лейкоцитов методом ЛХЛ. Сравнительная характеристика параметров СРС изучена на основании результатов, полученных при выполнении предыдущего (часть I) и настоящего исследований.
Подсчет лейкоцитов экссудата происходил в камере Горяева. Площадь раневых поверхностей вычислена методом плануметрии. Для окраски микропрепаратов применены гематоксилин-эозин, пикрофуксин по ван Гизону и PAS-реакция. В контрольной группе местное лечение ран не назначалось.
Сходство биологических процессов, отражающих закономерности заживления ран и язвенных дефектов, позволило считать принятую экспериментальную модель ран корректной и для изучения процессов СРО, свойственных язвенной болезни [ 5 ].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Ведущим оценочным фактором, характеризующим качество антиоксидантной защиты, является активность СОД, поскольку в присутствии СОД скорость дисмутации О2. возрастает почти в миллион раз. Аскорбат обладает значительными анти- и прооксидантными свойствами. И этот факт был ранее нами подтвержден [5]. Совместное же введение глюкозы и аскорбата привело к подавлению антиоксидантного эффекта аскорбата (рис.2), а также функциональной способности лейкоцитов, т.е. прооксидантной составляющей СРС (рис.3Б). Необходимо отметить, что при раздельном поступлении препаратов (рис 3А) прооксидантная активность лейкоцитов, начиная с 3-х суток, приобретала характер ножниц с инициацией аскорбатом пиковой активности и ее снижением глюкозой к 4-м суткам с момента инъекции.
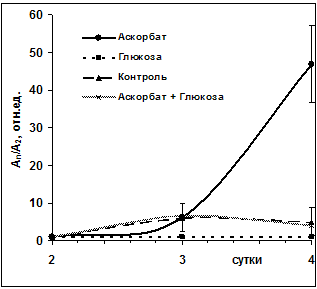
Рис 2 Изменение супероксиддисмутазной активности раневого экссудата: А2-активность на 2-е сутки. Аn-активность на 2-3-4 сутки
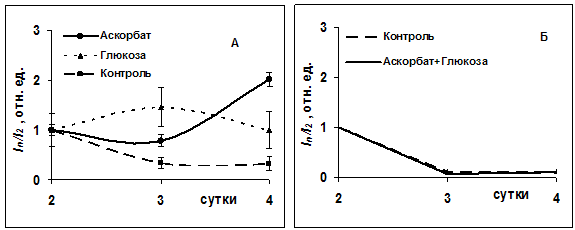
Рис.3 Изменение функциональной активности лейкоцитов раневого экссудата при раздельном (А) и совместном (Б) введении аскорбата и глюкозы: I2-интенсивность хемилюминесценценции лейкоцитов на 2-е сутки, In- на 2-3-4 сутки
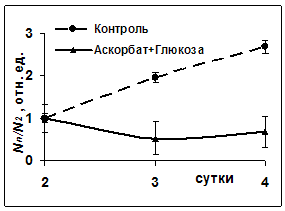
Рис.4 Изменение количества клеток в области раны при одновременном введении аскорбата и глюкозы: N2- количество лейкоцитов на 2-е сутки, Nn-на 2-3-4 сутки
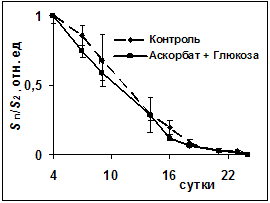
Рис.5 Динамика изменений площади ран: Sn- площадь раны на 2-3-4 сутки, S2- на 2-е сутки
Таким образом, глюкоза, независимо от способа введения, в конечном итоге вызывала торможение прооксидантного механизма СРС. Не было зарегистрировано различия в динамике заживления ран (рис.5). Однако качество заживления в опытных группах выглядело впечатляющим. Так, в камере Горяева (рис.4) изначально зафиксировано небольшое количество лейкоцитов экссудата по сравнению с крысами контрольной группы. И это означало возможность раннего наступления клеточно-тканевой пролиферации и формирования субстрата для построения коллагеновых волокон I и III типов в связи незначительной активностью реакций деструктивной фазы воспаления. У всех опытных животных уже на 6-е сутки наблюдались облигатные признаки начинающегося заживления и организации раневых дефектов: наползание уплощенного поверхностного эпителия на дно ран, очищенных от некротических масс, а также значительное содержание в этом эпителии и молодой грануляционной ткани PAS- положительного материала (рис.6), т.е. полиаминосахаридов- резервуаров энергообеспечения [5]. В грануляционной ткани отмечена умеренно выраженная воспалительная инфильтрация. Интенсивное образование в ранние сроки коллагеновых волокон, зрелость которых соответствовала 10-14 суткам течения раневого процесса (рис.7), свидетельствовало о полноценном качестве продолжающегося заживления экспериментальных ран. У контрольных крыс дно раневых дефектов было покрыто толстым слоем некротизированной ткани (рис.8),обильно инфильтрированной распадающимися лейкоцитами.
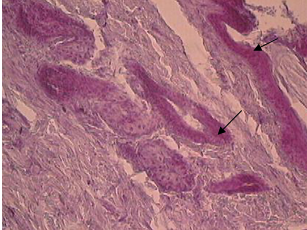
Рис.6 Накопление полиаминосахаридов в эпителии и дне раны PAS-реакция. х250
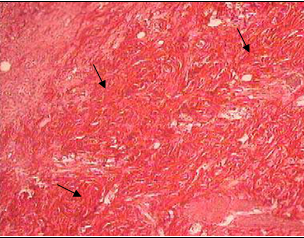
Рис.7 Пласты тонких и утолщенных коллагеновых волокон ван Гизон. х150
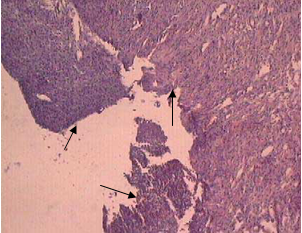
Рис.8 Некротические массы на поверхности дна раны Гематоксилин-эозин. х120
Итак, почему же, несмотря на угнетение констант СРС, показатели качества заживления оказались на достаточно высоком уровне? Ответ на этот вопрос, по нашему мнению, должен быть представлен на основании биофизических и биохимических механизмов взаимодействия глюкозы и аскорбата, а также патофизиологических особенностей архитектоники воспалительного процесса, сопровождающего массивные кровотечения, поскольку целью настоящего исследования является совершенствование метода ЭПМГ, выполняемого практически у всех пациентов с тяжелой кровопотерей [1,2].
Согласно современным представлениям, ВОСПАЛЕНИЕ - сложный патофизиологический симптомокомплекс, развивающийся в соответствии с законом единства и борьбы противоположностей и участием трех основных, закономерных и взаимозависимых реакций (альтерации, экссудации и пролиферации), протекающих параллельно, с превалированием деструктивных либо пролиферативных процессов в зависимости от активности перечисленных реакций. Это не только внешние проявления местного неблагополучия с классическими признаками Цельса, но и неизбежный, объективный и глубокий процесс, возникающий в результате ответной и защитной реакции на повреждение целостной биологической структуры. На любое подавление жизненно важных функций организм реагирует формированием катаболического каскада с синдромами системного воспалительного (SIRS) и гиперметаболического ответа, а также нарастанием энергетической недостаточности при дефиците энергообеспечения (рис.9). Мы акцентируем внимание на то, что успех лечения пациентов с нарушениями гомеостаза, в том числе при массивных кровотечениях, зависит от понимания клиницистами роли «внутреннего воспаления» в инициации катаболического каскада, имеющего место практически у всех тяжелых пациентов, независимо от этиологии заболевания. С ориентиром на последствия System Inflammation Response Syndrome (SIRS), представляющего ключевое звено в патогенезе катаболического каскада, и была разработана концепция метаболического гемо- и гомеостаза у больных с язвенными гастродуоденальными кровотечениями, осложненными тяжелой кровопотерей и геморрагическим шоком. Одновременное выполнение эндоскопического экстренного и превентивного метаболического гемостаза с инициацией фибриллогенеза, а также продолжительное энергообеспечение не только поврежденного субстрата, но и всего организма составляют суть концепции метаболической реабилитации пациентов с массивными кровотечениями[1,2,3]. В настоящее время не существует достойной альтернативы глюкозе как источнику энергообеспечения [1,2,3,6].Аэробный метаболизм глюкозы- основной вид получения энергии. При этом, в зависимости от путей расщепления глюкозы, выделяется 36-38 молекул АТР, а свободная энергия составляет 686000 кал. Энергетическая ценность 1г глюкозы-4 ккал. Это количество энергии обеспечивает окисление большей части лактата до воды и углекислого газа и синтез из его остатков гликогена и глюкозы (гликогеногенез и глюконеогенез).
Известно, что деструктивные повреждения тканей желудочно-кишечного тракта в той
или иной степени сопровождаются нарушениями аэробного обмена, преобладанием
тканевого гликолиза и дефицитом АТР вследствие гипоксии, ацидоза и гипоэргии,
составляющих «порочный круг»: ↔сосудисто-мышечный спазм ↔ болевой синдром ↔
моторно-эвакуаторные нарушения ↔ ухудшение микроциркуляции↔. По нашим
наблюдениям ликвидация боли на раннем этапе лечения язвенной болезни имеет
решающее значение в заживлении гастродуоденальных язв, предотвращении осложнений
и хронизации заболевания. Болевой синдром связан с перераздражением
парасимпатической нервной системы, открытием натриевых и кальциевых каналов,
увеличением внутриклеточной концентрации Са++. Закрытие этих каналов требует
больших энергетических затрат (АТР). Для релаксации гладкой мускулатуры,
т.е.купирования болей, также необходимо увеличение содержания в клетках
циклических нуклеотидов сАМР и сGMP, изгоняющих избыток Са++ из клеток, и к
синтезу которых глюкоза посредством АТР имеет непосредственное отношение [7].
При SIRS в случае истощения энергетических резервуаров продолжается накопление
лактата и прогрессирует ацидоз-причина дезорганизации метаболических процессов,
ферментных и транспортных систем ( в том числе, калиево-натриевого насоса) и
формирования субстрата СРО. Стремительное прогрессирование перекисного окисления
липидов при язвенных кровотечениях приводит к депрессии антиоксидантной защиты и
способствует некробиозу, некрозу и гибели клеток с нередкой картиной апоптоза
[2,8]. На фоне гипоксии, ацидоза, свободнорадикальных реакций и энергетического
кризиса происходят разрушение мембран лизосом и дегрануляция тучных клеток с
выбросом медиаторов воспаления. Состояние тучных клеток, универсальных
индикаторов повреждения, находится под контролем циклических нуклеотидов сAMP и
cGMP. Повышенное содержание сАМР ингибирует распад тучных клеток и неуправляемое
деление эпителиоцитов, способствуя их полноценной дифференцировке. Кроме того,
сАМР вызывает торможение воспалительных реакций путем предупреждения
аутокаталитической активизации вовлекающихся в процессы воспаления новых
ферментных систем [9]. Превалирование деструктивных процессов, дефицит
циклических нуклеотидов сAMP и cGMP изменяют и биологические свойства крови:
прогрессирует тромбообразование вследствие увеличения вязкости крови, замедления
кровотока, агрегации эритроцитов и тромбоцитов [10]. Ухудшение местного
кровотока может быть обусловлено и недостаточной концентрацией NADP,
глюкозозависимой дегидрогеназы, участвующей в регуляции обмена железа и
стабилизации гемоглобина. Нарушение процесса окисления атомов железа гемоглобина
![]() приводит к разрушению эритроцитов и формированию внутрисосудистых
сладжей [6]. Кроме того, утрата эритроцитами способности к деформации при
снижении содержания в них АТР только на 15% также значительно ухудшает
реологические свойства крови [11].Нарушения микроциркуляции и местного кровотока
создают условия, в которых образование коллагена становится невозможным.
приводит к разрушению эритроцитов и формированию внутрисосудистых
сладжей [6]. Кроме того, утрата эритроцитами способности к деформации при
снижении содержания в них АТР только на 15% также значительно ухудшает
реологические свойства крови [11].Нарушения микроциркуляции и местного кровотока
создают условия, в которых образование коллагена становится невозможным.
В таких ситуациях необходима экстренная и продолжительная метаболическая клеточная реанимация с инициацией аэробного обмена и фибриллогенеза [1,2].Глюкозе принадлежит приоритет в восстановлении физиологического и структурного метаболизма с помощью двух биохимических механизмов:1.макроэргического и 2.посредством стимуляции инсулиноподобного фактора роста [12].
Аскорбат, фундамент физиологии человека [13], наряду с глюкозой принимает участие в обеспечении фагоцитоза (в качестве прооксиданта) и практически всех наиболее важных функций, в том числе, регенерации тканей и стенок капилляров путем синтеза проколлагена и коллагена I и III типов, благодаря наличию в молекуле диенольной группы -СОН= = СОН- [1,2]. Синтез аскорбата (из глюкозы) происходит только у животных, а его потребности у человека покрываются за счет поступлений извне.
Аскорбат и глюкоза активно взаимодействуют. Пути их пересечения прослеживаются в комбинациях различных реакций. Но главное место встречи- матрикс внутренней митохондриальной мембраны, где глюкоза (макроэрг) и аскорбат (акцептор и донатор Н+) участвуют в сопряжении процессов гликолиза, окислительного фосфорилирования, синтеза АТР и восстановления О2 (рис.10), т.е. организации клеточного дыхания [ 6 ]
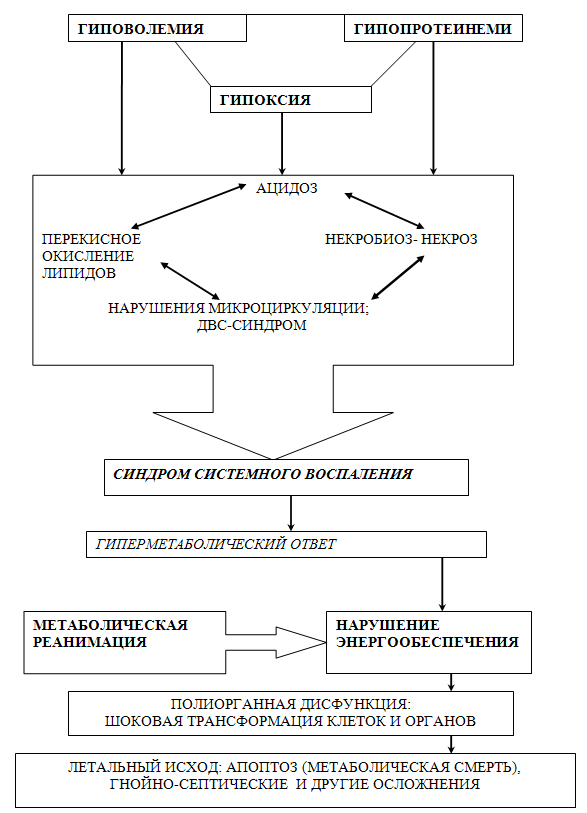
Рис. 9 Гиповолемический (геморрагический) шок – запуск катаболического каскада.
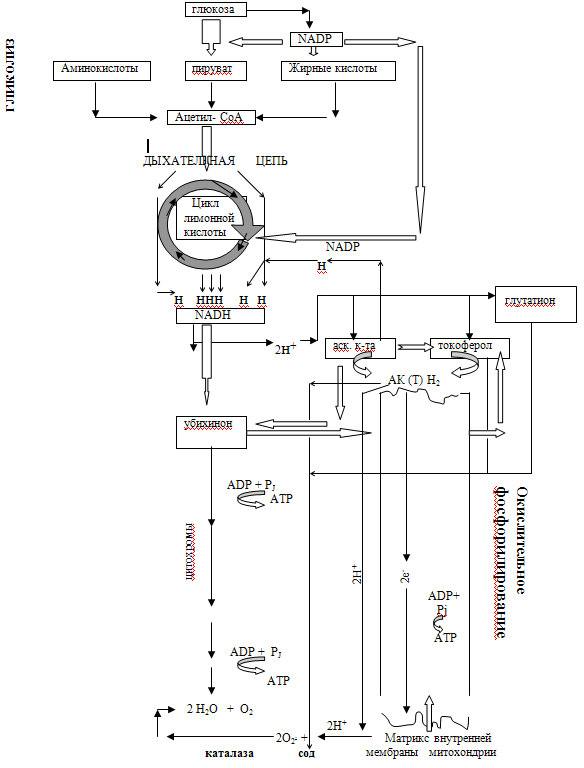
Рис.10 Глюкоза и аскорбиновая кислота в осуществлении клеточного дыхания и механизмов антиоксидантной защиты
При декомпенсированном метаболическом ацидозе, когда традиционные пути попадания в клетку глюкозы и аскорбата значительно ограничены, взаимодействие этих веществ с клеточными структурами осуществляется через специфические белки- транспортеры глюкозы (GLUI and GLU3), которые в неблагоприятных ситуациях выполняют роль переносчиков как глюкозы, так и аскорбата [14].При оксидативном стрессе внеклеточный аскорбат преобразуется в активный радикалдегидроаскорбат, попадающий в клетку с помощью переносчиков, где принимает участие не только в обеспечении метаболизма, но и становится посредником для внутриклеточного распространения глюкозы [15]. Адекватная циркуляция аскорбата происходит только при физиологических концентрациях глюкозы и нарушается при ее дефиците. Избыточное поступление аскорбата с пищей в организм животных приводит к торможению синтеза собственного аскорбата, дегидроаскорбата и биотрасформации глюкозы [13].
Мы полагаем, что в соответствии с механизмом отрицательной обратной связи при местном инъекционном лечении экспериментальных ран крыс смешанными растворами глюкозы и аскорбата угнетение функций аскорбата наступало вследствие его быстрого накопления до «критической массы», состоящей из: собственного аскорбата, а также введенного с инъекциями и синтезированного из глюкозы. Дополнительное отрицательное воздействие на прооксидантную активность аскорбата могла оказать и сама глюкоза (рис 3А).По нашему мнению, не исключается и конкурентный механизм реципрокного торможения акцепторов у переносчиков глюкозы-аскорбата. При этом низкая внутриклеточная концентрация препаратов оказалась недостаточной для инициации функциональной активности СОД и лейкоцитов (рис.2,3).
Тем не менее это не повлияло (с учетом конечного результата) на формирование физиологической концентрации глюкозы и аскорбата в клетках и выполнение главной задачи жизнеобеспечения- осуществление адекватного клеточного дыхания. .
Аскорбат, несмотря на супрессию анти- и прооксидантных функций (СОД- и фагоцитарной активности), обеспечил осуществление репаративного процесса, поскольку коллагеногенез не представляется возможным в отсутствие аскорбата, т.е. без транспорта электронов, окислительного фосфорилирования и построения комбинированной антиоксидантной защиты. Аскорбату принадлежит ведущая роль в регенерации убихинона (переносчика электронов) и антиоксиданта токоферола [5].Вероятно, при отсутствии аскорбатзависимой СОД-активности последняя могла быть компенсирована участием в дисмутации 02.глутатиона и токоферола (рис.10),
Быстрое разрешение деструктивного этапа воспаления практически без участия лейкоцитов (рис.4,6 и 7), по-видимому, было связано с фагоцитами нелейкоцитарного звена - макрофагами ретикулоэндотелиальной системы и недифференцированными мезенхимальными клетками.
Выполненные исследования (часть I и II) продемонстрировали высокий репаративный эффект аскорбата и глюкозы, независимо от способа введения. По нашим наблюдениям метаболическая реабилитация больных с угрозой кровотечения и осложненным течением язвенной болезни должна назначаться одновременно с проведением консервативной терапии либо оперативных вмешательств. Подобная тактика позволяет ограничить процессы альтерации и экссудации уже на ранних этапах лечения, добиться стойкой ликвидации болевого синдрома, сокращения сроков рубцевания гастродуоденальных язв, осуществить профилактику кровотечений и их рецидивов [1,2,3 ].
Таким образом, совместное введение глюкозы и аскорбата привело к депрессии параметров СРО, но не повлияло на качество заживления экспериментальных ран. Мы не можем полностью экстраполировать итоги исследования на выбор метода использования глюкозы и аскорбата в клинической практике, так как синтез аскорбата в организме человека не происходит. К сожалению современный уровень понимания патофизиологии ВОСПАЛЕНИЯ не позволил нам убедительно объяснить все полученные результаты, и поэтому отдельные положения в обсуждении имеют пока лишь теоретическое значение. Тем не менее на основании существующих представлений о значении реакций СРО в патогенезе тяжелых заболеваний, в том числе язвенных гастродуоденальных кровотечений [5,8], мы рекомендуем раздельное инъекционное введение растворов аскорбата и глюкозы при выполнении ЭПМГ.
Литература
- Тимен. Л.Я. Эндоскопический гемостаз у больных с язвенными гастродуоденальными кровотечениями и высокой степенью операционного риска /Л.Я. Тимен, А.Г. Шерцингер, А.В.Андреев, С.Б.Жигалова и др.// Мед. консультация. 1998. №2. С 22-31.
- Тимен. Л.Я. Геморрагический шок. Особенности эндоскопического гемостаза при язвенных гастродуоденальных кровотечениях ( патоморфологическое, экспериментальное и клиническое исследование) /Л.Я. Тимен, И.Е. Трубицына, Б.З. Чикунова, С.В. Стоногин и др. // Мед. консультация. 2003. №2. С 3-19.
- Васильева. А.А. Клинико-эндоскопическое обоснование программированного эндоскопического лечения массивных язвенных гастродуоденальных кровотечений / А.А.Васильева // Дисс. канд. Мед. наук. Москва-2004.
- Шерцингер, А.Г. Кровотечения после эндоскопических вмешательств на варикозных венах пищевода и желудка / А.Г. Шерцингер, С.Б.Жигалова, З.Ш. Маргиани, Л.Я. Тимен//Десятый юбилейный московский международный конгресс по эндоскопической хирургии. 19-21 апреля. 2006. С 256-257.
- Тимен, Л.Я. Аскорбиновая кислота и глюкоза в коррекции процессов свободнорадикального окисления (Экспериментальное исследование. ЧастьI) / Л.Я. Тимен, А.Г. Шерцингер, Т.В. Чичук, Э.С. Варданян и др.// Экспериментальная и клиническая гастроэнтерология.2005.№5.С 74-78.
- Murray, R. НARPER,S BIOCHEMISTRY / R Murray., D. Granner, P. Mayes., V.Rodwell // APPLETON & LANGE San Mateo. - California 1988. Vol.2. P 6-34.
- McCallum R.W. Calcium antagonism & Gastrointestinal motility. / R.W. McCallum., R., Radke, A. Smout et al //Experta medica. 1989. P.48.
- Утешев Н.С. Состояние перекисного окисления липидов и антиоксидантной системы у больных с гастродуоденальными язвенными кровотечениями при консервативном и оперативном лечении /Н.С. Утешев, Г.В.Пахомова, Л.Я. Тверитнева и др.//Вестн. Хир. им. Грекова 1999. т.157. №6. С.24-26.
- Логинов, А.С. Причина часто рецидивирующего течения хронической язвы желудка /А.С. Логинов, Г.Н.Соколова, В.Б.Потапова, И.Е. Трубицына // Рос. гастроэнтерол. журнал 1999.№2. С.52-55.
- Макаров, В.А. Горбунова Н.А // кн: Гемостаз и реология крови . Москва.2003.С 11.
- Соловьева Т.И. Микрогемореологические нарушения: характеристика и клиническое значение / Т.И.Соловьева, Е.А.Лукина // Тер. Архив.2006. №2. С. 87-91.
- Avena R. Insulin-like growth factor-1 receptors mediate infragenicular vascular smooth muscle cell prolifiration in response to glucose and insulin not by insulin receptors / R.Avena, M.E.,Mitchell, B.Carmody et all. Insulin-like growth factor-1 receptors mediate infragenicular vascular smooth muscle cell prolifiration in response to glucose and insulin not by insulin receptors.//Am.J. Surg.1999.V.178.№2 P.156-161
- F.J. Nualart Recycling of Vitamin C by a Bystander Effect. /.Nualart F.J., S.C. Rivas. C.I. Rumsey, V.P. Montecinos et all. //J. Biol. Chem., - 2003. – V. 278. – P. 10128-10133.
- Rumsey S.C. Glucose transporter isoforms GLU1 and GLU3 transport dehydroascorbic acid /S.C. Rumsey, O. Kwon, G.W. Xu et all. // J. Biol. Chem. – 1997. - V.272.- P. 18982-18989
- May J.M. Is ascorbic acid and antioxidant for plasma membrane? // FASER J.1999.N.13. P. 995-1006
Данные об авторах:
- Тимен Леонид Яковлевич – подполковник медицинской службы, член Американской академии медицинских наук, член американской академии наук, врач-эндоскопист высшей категории 20-й городской клинической больницы г. Москвы раб. Тел. 471-33-62. 129327 Москва, Ленская 15, 3-й корпус, отделение эндоскопии.
- Шерцингер Александр Георгиевич – доктор медицинских наук, руководитель отдела экстренной хирургии Научного центра хирургии Российской академии медицинских наук. 129327 Москва, Ленская 15, 5-й корпус, 3-е хирургическое отделение.
- Жигалова Светлана Борисовна – ассистент кафедры хирургических болезней N2 Московской медицинской академии имени И.М. Сеченова на базе городской клинической больницы N20 г. Москвы, кандидат медицинских наук. Раб. Тел. 471-08-98. 129327 Москва, Ленская 15, 5-й корпус, 3-е хирургическое отделение.
- Стоногин Сергей Васильевич – хирург инфекционного корпуса Тушинской детской городской больницы г. Москвы, кандидат медицинских наук. 143406 Красногорск, Железнодорожная 28А 24. E-mail: svas@vpost.ru
Принятые сокращения:
ЛХЛ - люминол-зависимая хемилюминесценция
02. -супероксид анион-радикал
СОД - супероксиддисмутаза
СРО - свободнорадикальное окисление
СРС - свободнорадикальный статус
ЭПМГ - эндоскопический превентивный метаболический гемо-и гомеостаз
АDP - аденозиндифосфат
АТР - аденозинтрифосфат
сAMP- циклический аденозинмонофосфат
сGMP- циклический гуанозинмонофосфат
NADP-никотинамидаденозиндинуклеотидфосфат
Pj- неорганический фосфат
SIRS- синдром системного воспалительного ответа