Молекулярно-цитогенетическая диагностика хромосомных аномалий у супружеских пар
|
В процессе генетического консультирования супружеских пар с нарушением репродуктивной функции (НРФ) при выяснении причин возникновения бесплодия, спонтанных абортов, рождения ребенка с множественными врожденными пороками развития (МВПР) и/или микроаномалиями развития (МАР), а также при определении повторного риска данных негативных событий в семье и тактики проведения пренатальной диагностики ведущая роль принадлежит цитогенетическим исследованиям.
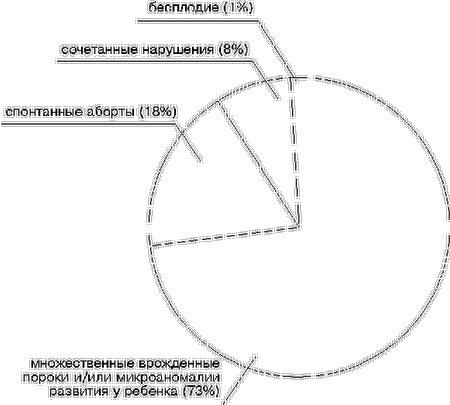
Опыт генетического консультирования [1, 2] свидетельствует о том, что примерно каждая 8-я супружеская пара с НРФ нуждается в цитогенетической диагностике. Определение носителей той или иной хромосомной патологии у супругов с НРФ невозможно без цитогенетического анализа, так как хромосомные нарушения у фенотипически здоровых индивидуумов встречаются, как правило, либо в сбалансированном состоянии (транслокации, инверсии), либо в виде “скрытого” минимального мозаицизма, либо при дополнительной маркерной хромосоме. Методы традиционной цитогенетики не могут полностью обеспечить эффективность выявления и анализа подобной патологии. В данной ситуации применяется молекулярно-цитогенетическая диагностика. В последнее время используя молекулярно-цитогенетические методы и хромосомоспецифичные ДНК-пробы на все хромосомы и их участки появилась возможность диагностики всех ранее недифференцированных хромосомных аномалий у супружеских пар с НРФ [2, 3]. В настоящей работе представлен анализ результатов комплексного цитогенетического и молекулярно-цитогенетического обследования 290 супружеских пар с НРФ, обратившихся за генетической консультацией в течение 10 лет. Материал и методы Традиционное цитогенетическое исследование каждой супружеской паре проводилось по показаниям, принятым в клинической генетике: наличие в анамнезе ребенка c хромосомными аномалиями, МВПР и/или MAP, спонтанных абортов на различных сроках беременности, мертворождений и бесплодия [4]. Средний возраст супружеских пар с НРФ для женщин составил 28,9 года, а для мужчин 30,6 года. Цитогенетическая и молекулярно-цитогенетическая диагностика у супружеских пар с НРФ проводилась на препаратах метафазных и интерфазных хромосом, которые готовили по общепринятому методу [5]. Хромосомы идентифицировали после дифференциального окрашивания (С-метод, G-метод) при увеличении 1125. При метафазном анализе учитывали не менее 11 метафаз, при интерфазном – не менее 100 клеток. В случае обнаружения хромосомной нестабильности (дицентрики, кольца, парные фрагменты, хромосомные и хроматидные разрывы, пробелы) анализировали также по 100 метафазных пластинок. Молекулярно-цитогенетическая диагностика при помощи гибридизации клонированных последовательностей ДНК с метафазными и интерфазными хромосомами в условиях in situ проводилась по ранее описанным методам [6, 7] с последующими модификациями [8]. Результаты молекулярной гибридизации оценивали с помощью анализа интерфазных и метафазных клеток [9, 10]. В случае мозаицизма идентифицировали не менее 100 клеток. При этом применяли оригинальную коллекцию альфоидных, “классических” сателлитных и сайтспецифичных ДНК-проб, полученных в лаборатории цитогенетики научного центра психического здоровья РАМН [11, 12]. Для определения происхождения маркерных хромосом применялась оригинальная тактика диагностики [13]. Запись цитогенетического и молекулярно-цитогенетического диагноза производилась по международной номенклатуре стандартизации цитогенетических исследований [14]. Результаты и обсуждение Анализ причин обращения супружеских пар с НРФ показал, что наиболее часто встречались семьи, имеющие ребенка с МВПР и/или MAP – 210 (73%), реже со спонтанными абортами – 53 (18%), с сочетанными нарушениями – 23 (8%) и с бесплодием – 4 (1%) (рис. 1).
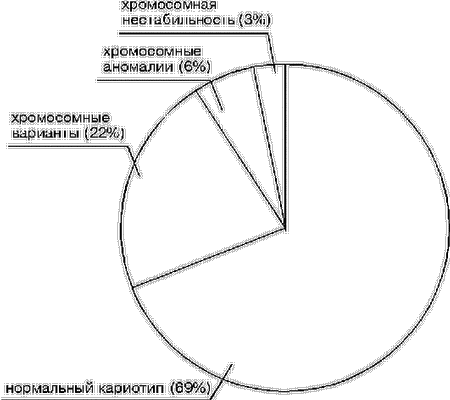
В результате анализа кариотипа супружеских пар с НРФ у 35 (6%) из 580 пациентов были выявлены хромосомные аномалии. У 127 (22%) индивидуумов были обнаружены хромосомные варианты, у 17 (3%) – хромосомная нестабильность, а у 401 (69%) индивидуума каких-либо кариологических особенностей не наблюдалось, т.е. кариотип был нормальным (рис. 2).
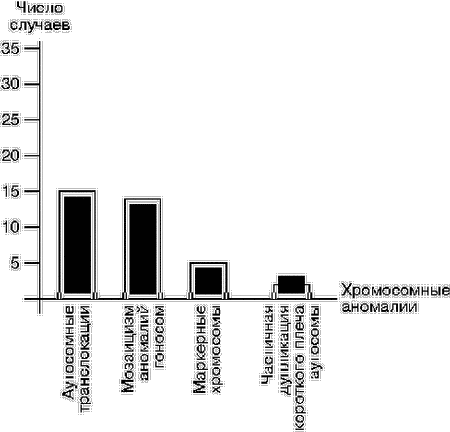
Результаты сравнительного анализа частоты различных цитогенетических особенностей в зависимости от конкретного повода обращения свидетельствуют о том, что в группе супружеских пар со спонтанными абортами повышена частота нестабильности хромосом (9 из 17 случаев). Подобные данные получены и другими исследователями [15]. У 210 (73%) пар, у которых отмечено рождение ребенка с МВПР и/или MAP, хромосомные аномалии и хромосомные варианты выявлялись чаще, чем в остальных группах: 23 случая из 35 обнаруженных хромосомных аномалий и 89 случаев из 127 хромосомных вариантов. На основании наших и ранее полученных результатов [16,17] можно заключить, что основная (или одна из основных) причина обращения супругов в генетическую консультацию несомненно связана с теми или иными хромосомными нарушениями. Результаты наших исследований показывают, что частота хромосомных аномалий у супружеских пар с НРФ составляет 6%. Подобные работы, проведенные ранее другими исследователями, свидетельствуют также о высоком удельном весе (от 4,3 до 9,6%) хромосомной патологии у пациентов, обратившихся в генетическую консультацию по аналогичным причинам [2, 18, 19]. Из обнаруженных 35 случаев носителей хромосомных аномалий (рис. 3) большинство составили сбалансированные аутосомные транслокации, которые выявили у 15 пациентов, и мозаицизм аномалий гоносом – у 14 индивидуумов. Маркерные хромосомы наблюдали у 5 пациентов, а у 1 – дупликацию (дополнительный хромосомный материал) короткого плеча хромосомы 22. В процессе исследования были установлены семейные случаи хромосомных аномалий, среди которых 7 случаев структурных сбалансированных транслокаций, 3 – гоносомных синдрома (синдром Шерешевского–Тернера, включая изохромосому X), 1 – частичной дупликации, а также 3 – различных маркерных хромосом у родителей. Их дети имели хромосомную аномалию с различными врожденными пороками развития (ВПР) и/или MAP, а также задержку психомоторного развития (ЗПМР). Во всех случаях родители оставались фенотипически здоровыми.
Из 35 случаев хромосомных аномалий в 15 вставал вопрос о проведении молекулярно-цитогенетической диагностики. Особый интерес представляли случаи, в которых обнаруженные хромосомные аномалии после проведения цитогенетического исследования у родителей и детей определялись как идентичные. В ситуациях, когда речь шла о транслокациях, перед нами встал вопрос о “сбалансированности” подобных перестроек у детей или, другими словами, о возможной потере хромосомного материала, неидентифицированного на цитогенетическом уровне. Для решения этого вопроса возникала необходимость уточнения точек разрыва на транслоцированных хромосомах. Примеры подобных случаев представлены в таблице (случаи № 6 и 7). Так, у матери при цитогенетическом анализе была обнаружена дицентрическая транслокация (15; 18), подобная транслокация у ребенка. При этом мать – фенотипически здорова, а у ребенка отмечалась олигофрения и множество микроаномалий развития. Традиционные цитогенетические методы с применением дифференциального окрашивания хромосом оказались малоэффективны. Для уточнения точек разрыва в транслоцированных хромосомах использовали альфоидные ДНК-пробы pPD18 (хромосома 15) [20] и pYAМ3-86, PAC36.15.G (хромосома 18) [12]. После проведения молекулярно-цитогенетической диагностики у пробанда обнаружена делеция короткого плеча хромосомы 18, т.е. 18р-синдром. У матери подтвердилось наличие сбалансированной транслокации с кариотипом: 45,XX,diсt (15;18) (p11;p11). isht(15;18)(p11;p11)(pPD18ґ2,pYAM3-86ґ2, PAС36.15.Gґ2). Кариотип ребенка имел следующую форму записи: 45,XY,dict (15;18)(р11;р11). isht(15;18)(p11;p11.31)(pPd18ґ2, pYА3-86ґ2, PAC36.15. Gґ1). Аналогичные результаты были получены при диагностике транслокации (4;7) у матери и ребенка (см. таблицу, случай 7). В результате молекулярно-цитогенетического исследования обнаружена сбалансированная транслокация у матери и несбалансированная транслокация у ребенка, определяющая множественные MAP и умственную отсталость. Молекулярно-цитогенетическую диагностику применяли и для выяснения добавочного хромосомного материала неизвестного происхождения (addition – add) на коротком плече хромосомы 22 у матери и ребенка (см. таблицу, № 8) в случаях, когда мать фенотипически здорова, а у ребенка наблюдались ЗПМР и MAP. Для этого были использованы следующие ДНК-пробы: 1) альфа-сателлитная (MСG14-22, cosВ103), 2) “классическая” сателлитная (рРD 9), 3) рибосомальная (cos13-36), 4) теломерная (РАС 90.14.В). После оценки результатов молекулярно-цитогенетического исследования показано, что увеличение короткого плеча хромосомы 22 в обоих случаях происходит за счет рибосомальной ДНК. Это позволяет предположить, что данный дополнительный хромосомный материал не является причиной ЗПМР и MAP у ребенка. Следует отметить, что цитогенетическая постановка диагноза была затруднительна также в случаях мозаицизма анеуплоидий половых хромосом, который обнаружен у 14 индивидуумов. Мозаичные формы, как правило, создают большие трудности при идентификации патологии, так как незначительный клон аномальных клеток может быть утрачен на одном из этапов цитогенетического исследования. Своевременная идентификация мозаицизма по анеуплоидии гоносом (особенно с небольшим числом аномальных клеток) очень важна, поскольку у носителей гоносомного мозаицизма, как правило, сохранена способность воспроизводить потомство. В нашем исследовании мозаичные формы в основном были представлены двумя клонами клеток – нормальным и аномальным, у некоторых индивидуумов было обнаружено и три клона клеток (см. таблицу, № 11). Мозаицизм выявлен с помощью методов традиционного цитогенетического анализа у 7 индивидуумов, а 7 пациентам диагноз мозаицизма поставлен с помощью молекулярно-цитогенетической диагностики, причем в одном из них была обнаружена изохромосома Xq (см. таблицу, № 12). Следует отметить, что в диагностике мозаицизма можно использовать для анализа и интерфазные клетки. В представленных случаях использовался как интерфазный, так и метафазный анализ, результаты которых были идентичны. Таким образом, на основании интерфазного и метафазного анализов хромосом после молекулярной гибридизации поставлены диагнозы мозаицизма в 7 случаях (см. таблицу, № 9–15). “Скрытый” аномальный клон клеток обнаружен в минимальном проценте (до 15). Цитогенетическая и молекулярно-цитогенетическая диагностика хромосомных аномалий, обнаруженных у супружеских пар с НРФ
Диагностика маркерных хромосом методами цитогенетического анализа оказалась также малоинформативной. Маркерные хромосомы представляли собой добавочный хромосомный материал в виде акроцентрической или метацентрической хромосомы с постоянным присутствием околоцентромерного гетерохроматина и центромеры. Использование клонированных последовательностей ДНК (ДНК-зондов) при гибридизации нуклеиновых кислот in situ позволило определить происхождение, т.е. состав маркерных хромосом (см. таблицу, № 1–5). Как видно из таблицы, маркерные хромосомы, обнаруженные у индивидуумов, были дериватом хромосом 21, X, Y. Более чем у 1/5 обследованных супругов – у 127 (22%) в результате цитогенетического исследования были выявлены хромосомные варианты (1qh+, 9qh+, 9phqh, 14cenh+, 15cenh+, 16qh+, 17ps, 21cenh+, 22cenh+, Yqh+), связанные с увеличением гетерохроматиновых районов хромосом или инверсией околоцентромерного гетерохроматина. Наиболее часто (13,8%) встречались варианты 1qh+, 9qh+, 16qh+ и Yqh+, что существенно отличалось от их частоты в нормальной популяции (1,6%) [21]. При молекулярно-цитогенетическом изучении экстремального варианта хромосомы 1 используя ДНК-пробы на “классическую” сателлитную и альфа-сателлитную ДНК (ДНК-пробы pUС 1.77 и aR1-12 соответственно) было показано, что увеличение размеров гетерохроматинового района хромосом связано с повышенным содержанием числа копий “классической” сателлитной ДНК, причем эти два различных типа повторяющихся ДНК варьируют независимо друг от друга. Влияние экстремальных вариантов хромосом 1, 9, 16 и Y, обнаруживаемых у супружеских пар, на репродуктивную функцию, в результате нарушения которой могут происходить негативные события в семье, требует дальнейшего изучения. В литературе имеются сообщения о повышенной частоте хромосомной нестабильности (5,5%) у супружеских пар с повторными спонтанными абортами [15], результаты наших исследований не подтверждают эти данные. Выводы Таким образом, результаты проведенных исследований свидетельствуют прежде всего о большом значении цитогенетической и молекулярно-цитогенетической диагностики в практике генетического консультирования. Цитогенетическая диагностика супружеских пар с НРФ позволила выделить группу индивидуумов, нуждающихся в молекулярно-цитогенетических методах исследования. Выявлено, что более чем в 40% случаев (15 из 35 пациентов) необходимо проведение молекулярно-цитогенетической диагностики. Полученные данные показывают, что молекулярно-цитогенетическая диагностика при генетическом консультировании супружеских пар с НРФ необходима: 1) для идентификации хромосомных аномалий после малоэффективной классической цитогенетической диагностики (семейные структурные сбалансированные перестройки хромосом, мозаицизм гоносом, маркерные хромосомы); 2) для определения нескольких хромосомных анеуплоидий с помощью FISH при применении ДНК-проб различной хромосомной специфичности; 3) при исследовании хромосомных вариантов с целью изучения возможных корреляций их экстремальности с нарушением репродуктивной функции, т.е. применяя молекулярно-цитогенетические методы, можно идентифицировать и изучить весь спектр хромосомных аберраций, встречаемый у супружеских пар с НРФ. Своевременная и точная диагностика хромосомных аномалий у супружеских пар с НРФ повышает эффективность генетического консультирования и пренатальной диагностики и, следовательно, позволяет предупредить распространение таких социально значимых болезней, как хромосомные синдромы, в семье и обществе. С.Г. Ворсанова, А.К. Берешева, Л.З. Казанцева, И.А. Демидова, В.О. Шаронин, И.В. Соловьев, Ю.Б. Юров Московский НИИ педиатрии и детской хирургии Минздрава РФ, Научный центр психического здоровья РАМН, Москва. ЛИТЕРАТУРА 1. Loan D., Dumitrii J., Museteanu P., Ioanitic D., Pop Т., Maximilian C. Cytogenetic investigation in 300 couples with recurrent fetal wastage. Rev roum med Endocrinol 1987; 25: 3: 145–148. 2. Ворсанова С.Г., Казанцева Л.З., Берешева А.К., Демидова И.А. Результаты молекулярно-цитогенетической диагностики супружеских пар с нарушением репродуктивной функции при медико-генетическом консультировании. Респ. сборник научных трудов “Молекулярная диагностика наследственных болезней и медико-генетическое консультирование” М 1995; 124–131. 3. Vorsanova S.G., Beresheva A.K., Demidova I.A., Kasantseva L.Z., Kolotii A.D., Soloviev I.V., Malet P., Yurov Yu.B. Molecular-cytogenetic diagnosis in genetic counselling of couples with failure of reproductive function. Cytogenetics and Cell Genetics 1997; 77: 1–2. 4. Козлова С.И., Прытков А.Н. Методика проведения медико-генетического консультирования (методические рекомендации). М/ 1981; 5–6. 5. Hungerford D.A. Leucocytes cultured from small inocul of whole blood and the preparation of metaphase chromosomes by treatment with hypotonic KCl. Stain Techn 1955; 40: 333–338. 6. Chandler M.E., Yunis J.J. A high resolution in situ hybridisation technique for the direct visualisation of labelled G-banded early metaphase and prophase chromosomes. Cytogenet Cell Genet 1978; 22: 352–356. 7. Юров Ю.Б. Оптимизация условий гибридизации клонированных последовательностей ДНК in situ и дифференциального окрашивания хромосом человека. Бюлл эксперим биол и медицины 1984; 5: 595–598. 8. Soloviev I.V., Yurov Y.B., Yorsanova S.G., Malet P. Microwave activation of fluorescence in situ hybridization: a novel method for rapid chromosome detection and analysis. Focus 1994; 16: 4: 115–116. 9. Ворсанова С.Г., Юров Ю.Б., Дерягин Г.В., Соловьев И.В., Бытенская Г.А. К методике диагностики анеуплоидий при помощи гибридизации in situ: анализ интерфазных ядер. Бюл эксперим биолог и мед 1991; 10: 413–415. 10. Yurov Yu.B., Soloviev I.V., Vorsanova S.G., Marcais В., Lewis R., Roises G. High resolution milticolor fluorescence in situ hybridisation using cyanine and fluorescein dyes: ultra rapid chromosome detection by directly fluorescently-labeled alphoid DNA probes. Hum Genet 1996; 97: 390–398. 11. Юров Ю.Б., Александров И.А., Миткевич С.П., Яковлев А.Г., Рогаев Е.И., Ворсанова С.Г. Молекулярные маркеры для гетерохроматиновых районов хромосом человека. Хромосомы человека в норме и патологии. М. МОИП, Наука 1989; 63–73. 12. Yurov Y.B., Soloviev I.V., Yorsanova S.G., Alexandrov I.A., Sharonin V.O., Monachov V. DNA probes for pre- and postnatal diagnosis of cromosomal anomalies: a collection for FISH analysis. Cesko-slovenska pediatrie 1997; 52: 7: 550–554. 13. Vorsanova S.G., Yurov Y.B., Soloviev I.V., Demidova I.A., Malet P. Rapid identification of marker chromosomes by in situ hybridization under different stringency conditions. An Gell Patol 1994; 7: 251–258. 14. ISCN (An International System for Human Cytogenetic Nomenclature. Cytogenetics and Cell Genetics 1995; 114. 15. Banerjee P., Talukder G., Sharma A. Chromosomal alterations in recurrent abortions. Bionature 1988; 8: 1: 19–24. 16. Brecevic L. Anomalije kromosoma u parova s ponawljanim repraductivnim gubicima. Arh majke i diet 1987; 31: 1: 39–40. 17. Ворсанова С.Г., Казанцева Л.З., Демидова И.А., Дерягин Г.В. Цитогенетическая диагностика у супружеских пар с отягощенным акушерским анамнезом. Вопросы охраны материнства и детства 1989; 6: 52–56. 18. Martens P., Welroy S., Tharapel A., Summitt R. Cytogenetic findings in 255 couples referred, for multiple fetal loss. Amer J Hum Genet 1984; 36: 4: 103. 19. Bourronillon C., Golombies P., Dastugue N. Chromosome studies in 136 couples with spontaneous abortions. Hum Genet 1986; 74: 4: 399–401. 20. Deininger Р.L., Jollu D.J., Rubin C., Freidmann Т., Schmidt C.W. Base sequence studies of 300 nucleotide renaturated repeated human DNA clones. J Mol Biol 1981; 151: 17–33. 21. Hsu L.Y., Benn P.A., Tannenbaum H.L., Perlis Т.Е., Carison A.D. Chromosomal polimorphisms of 1, 9, 16 and Y in 4 major ethnic groups: a large prenatal study. Amer J of Medical Genet 1987; 26: 95–101. |