Трансфекция маточного эпителия при осеменении крольчих трансформированными сперматозоидами
|
Словарь
Эндоцитоз — процесс проникновения веществ через мембрану, в основе которого лежит способность клетки активно поглощать вещества из окружающей среды в виде маленьких пузырьков. Экзоцитоз — процесс, обратный эндоцитозу. Интернализация (internal — внутренний) — попадание веществ внутрь клетки, обычно, при участии специфических рецепторов. Пенетрация (penetration — проникать, проходить сквозь, входить, пронизывать) – проникновение крупных частиц (спермии, бактерии) в клетку с использованием специальных механизмов. Трансфекция — процесс проникновения ДНК в клетку. Трансформация спермиев — процесс включения в спермии чужеродной ДНК. Репортерная плазмида — кольцевая ДНК, кодирующая гены, которые позволяют легко ее идентифицировать после трансфекции в результате экспрессии. Экспрессия гена — процесс считывания генетической информации с ДНК и,„ обычно, образование закодированного белка. Моноклональные антитела — антитела, полученные от одного клона продуцирующих их клеток и взаимодействующие с определенной частью поверхности антитела. Нокаутированное животное — животное, у которого удален определенный ген. Ранее были представлены данные по кинетике [1, 2] и топографии [3] связывания экзогенной ДНК эякулированными сперматозоидами кролика. Был разработан способ трансформации мужских гамет ДНК с применением диметилсульфоксида (ДМСО) и теплового шока [4, 5]. Показано, что трансформированные спермии при искусственном осеменении самок вносят рекомбинантные ДНК в яйцеклетки, и эти ДНК способны экспрессироваться [3, 4] и встраиваться в геном [6]. Отмечен ряд аномалий в развитии доимплантационных эмбрионов, вызванных посторонними ДНК, внесенными спермиями [7]. В настоящей работе описан феномен инфицирования спермиями клеток поверхностного цилиндрического эпителия матки экзогенной ДНК. Приводятся результаты экспериментов, направленных на понимание механизмов взаимодействия ДНК и сперматозоида. Предлагается модель захвата, сохранения и частичного выброса сперматозоидами посторонней ДНК, объясняющая их способность трансфецировать экзогенной ДНК удаленные клетки. Материал и методы Подготовка спермиев. Эякуляты получали от половозрелых кроликов, сперматозоиды отмывали от семенной жидкости и оценивали их подвижность под микроскопом; семенную жидкость получали как описано ранее [1, 4]. ДНК. В экспериментах использовали плазмиду pRK3lacZ [6, 8]. ДНК метили [a-32P]dNTP при помощи реакции ник-трансляции [4]. Радиоактивную ДНК инкубировали при комнатной температуре с 106–108 спермиев в присутствии различных агентов: бычьего сывороточного альбумина (БСА) (15 мг/мл), ДМСО (3%), сыворотки крови кролика (50%) об/об), семенной жидкости кролика или человека (50% об/об), хлороквина (1 мг/мл), азида натрия (15 мМ), гепарина (1000 Ед/мл), глутарового альдегида (2,5%), либо прогревали спермии при 60°С в течение 5 мин. По истечении 30 мин инкубации реакцию останавливали стократным разбавлением, спермии отделяли центрифугированием и определяли радиоактивность высушенного осадка [4]. Радиоактивность связанной ДНК выражали в % по отношению к добавленной ДНК. Трансформация сперматозоидов. ДНК в количестве 10 мкг в 50 мкл буфера ТЕ, содержащего 10 мМ трис-НСl (рН 8,0) и 1 мМ EDTA, добавляли к суспензии сперматозоидов кролика, 5·106 клеток в 500 мкл раствора Эрла. Инкубацию проводили в течение 30 мин при комнатной температуре. Суспензию клеток после разведения раствором Эрла использовали для искусственного осеменения крольчих (500 мкл на одну самку). Контрольные эксперименты проводили без добавления ДНК. Осеменение крольчих в фазе эструса осуществляли катетером, вводя в вагину 100–200 мкл суспензии спермиев. Через 12 дней животных забивали, препарировали матку и под микроскопом отделяли эндометрий. Активность бактериальной b-галактозидазы в тканях выявляли с помощью Х-gal (400 мкг/мл) при 30°С в присутствии 150 мкг/мл хлороквина для ингибирования активности эндогенной b-галактозидазы [3]. Результаты Блокировка интернализации ДНК в спермии хлороквином. Изучали влияние ингибитора эндоцитоза — хлороквина на процесс взаимодействия радиоактивной экзогенной ДНК и сперматозоидов. В опытах использовали также ДМСО, увеличивающий проницаемость клеточных мембран [9], для того, чтобы шунтировать заблокированный хлороквином гипотетический везикулярный транспорт меченой ДНК. Предварительная обработка спермиев кролика в течение 30 мин хлороквином в концентрации, в 50 раз превышающей минимальную ингибирующую концентрацию — 80 мкМ [10], уменьшала количество связанной радиоактивной ДНК до 4,7%. Дополнительное введение в систему 3% ДМСО снимало ингибирующий эффект хлороквина (табл. 1). Подобное явление не наблюдали в экспериментах с использованием азида натрия, разобщающего окислительное фосфорилирование. Инкубирование спермиев кролика с радиоактивной ДНК в присутствии 15 мМ NaN3 приводило в течение первых 30 мин к связыванию 10,4% радиоактивности, через 60 мин к поглощению 41,6% 32Р-ДНК, а через 120 мин — 45,1% метки. Получасовая инкубация таких сперматозоидов в присутствии 3% ДМСО не приводила к связыванию значительных количеств дополнительной радиоактивной ДНК.
Связывание ДНК сперматозоидами при различных условиях. Отмытые от семенной жидкости спермии кролика через 30 мин инкубирования связывали 65±5% радиоактивной ДНК (табл. 2). В присутствии сыворотки крови кролика эта величина составляла 30±3%. Прогрев спермиев в течение 5 мин при 60°С вызывал некроспермию, с клетками связывалось 28±3% ДНК. Добавление семенной жидкости кролика или человека до 50% (об/об) уменьшало количество связанной меченой ДНК соответственно до 17±2 и 16±2%. В присутствии 1 мг/мл хлороквина сперматозоиды сохраняли двигательную активность и связывали 14±2% ДНК. Напротив, 15 мМ азид натрия приводил к обездвиживанию спермиев и связыванию 10±2% горячей ДНК. В присутствии 2,5% глутарового альдегида спермии кролика теряли подвижность и связывали 5±1% ДНК. Когда в суспензию добавляли гепарин (1000 Ед/мл) связывалось 1±1% ДНК. В 3% ДМСО сперматозоиды связывали 78±4% ДНК, а в присутствии 15 мг/мл БСА доля связанной ДНК составляла 97±2%.
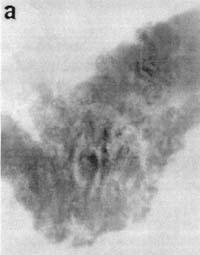
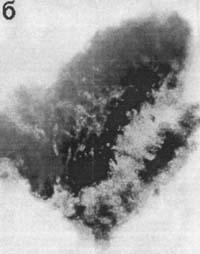
Выявление экспрессии гена RSVlacZ в эндометрии матки Отпрепарированная на 12-й день беременности крольчих слизистая оболочка, выстилающая полость тела матки, была пронизана трубчатыми железами, которые открывались на поверхности эпителия (рис. 1). Поверхностный функциональный слой эндометрия контрольных самок, покрытых самцами, не окрашивался X-gal в присутствии ингибитора эукариотической b-галактозидазы — хлороквина (см. рис. 1,а). В случае искусственного осеменения крольчих сперматозоидами, трансформированными плазмидой pRK3lacZ, мы наблюдали яркое сине-зеленое окрашивание клеток поверхностного, толстого слоя эндометрия после гистохимического окрашивания X-gal (см. рис. 1,б), свидетельствующее об экспрессии бактериального гена lacZ.
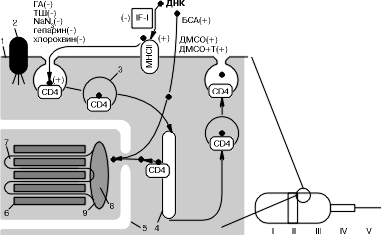
Обсуждение В литературе сообщалось, что ретровирусы, которые размножаются в репродуктивном тракте самцов мышей, связываются поверхностью сперматозоидов и могут быть перенесены в удаленные клетки [11]. Показано, что сперматозоиды человека способны связывать частицы вируса иммунодефицита (ВИЧ) [12]. В лаборатории Gerard J. Nuovo показано, что ВИЧ атакует в мужском генитальном тракте клетки, формирующие спермии (сперматоциты), разрушает их и переносится со спермой в половой тракт женщины, далее ВИЧ внедряется в тело, атакуя макрофаги в шейке матки [13]. В обоих случаях рецептором для ВИЧ является поверхностный антиген CD4, а вирус, вероятно, передается с CD4 поверхности спермия на CD4 мембраны макрофага. Группой Corrado Spadafora показано, что экзогенная ДНК тоже связывается с рецептором CD4 на поверхности зрелых спермиев мыши. Белок CD4 опосредует интернализацию ДНК в спермий. Специфические к CD4 моноклональные антитела предотвращали связывание ДНК со сперматозоидами. Не поглощали ДНК и спермии нокаутированных по гену CD4 мышей [14]. Следует заметить, однако, что первоначальный акт взаимодействия ДНК и сперматозоида (1-я фаза — адсорбция) осуществляется за счет другого, отличного от CD4 белка. По данным G. Wu и соавт. [15], таким высокоаффинным рецептором ДНК являются молекулы главного комплекса гистосовместимости II (МНСII), обнаруженные ими на спермиях мыши. Оба белка (СD4, МНСII) располагаются в постакросомной области головки спермия — зоне III [16] (рис. 2).
ГА — глутаровый альдегид; ТШ — тепловой шок. 1 — плазмалемма сперматозоида; 2 — связанный с цитоскелетом интегральный белок, разделяющий мембранные домены; 3 — везикула; 4 — везикула, высвобождающая связанную ДНК; 5 — ядерная оболочка; 6 — протамины; 7 — хромосомная ДНК; 8 — ядерный матрикс; 9 — ядерный аннулус; +/– — активация/ингибирование процесса захвата ДНК; I—V — зоны на поверхности спермия согласно [3, 16]. В наших экспериментах со сперматозоидами кролика связывалось в среднем 65% добавленной ДНК, что несколько выше, чем для других видов животных [17]. Сыворотка крови кролика уменьшала количество связанной ДНК примерно наполовину (30%). Прогревание спермиев при 60 °С в течение 5 мин приводило к их обездвиживанию и связыванию ~28% ДНК, что указывало на частичную денатурацию белковых факторов, ответственных за взаимодействие с ДНК. Добавление семенной жидкости кролика или человека позволяло связаться 16–17% меченой ДНК, указывая на присутствие в семенной плазме видонеспецифического ингибитора. Такой белок был выделен из спермы морского ежа и получил название IF-1 [18]. В присутствии ингибитора эндоцитоза — хлороквина — спермии кролика сохраняли подвижность и связывали в среднем 14% ДНК. Напротив, азид натрия — разобщитель окислительного фосфорилирования — приводил к некроспермии и связыванию 10% добавленной радиоактивной ДНК. В присутствии бифункционального агента — глутарового альдегида — спермии кролика также теряли двигательную активность и связывали 5% ДНК, что может быть результатом образования перекрестных сшивок между лабильными макромолекулами, участвующими в движении спермиев и захвате ДНК. Наибольший ингибирующий эффект вызывал полианион гепарин (1% связанной ДНК), возможно конкурирующий за сайты связывания ДНК. ДМСО, увеличивающий проницаемость мембран, приводил к связыванию 78% ДНК, а БСА доводил долю связанной ДНК до 97% за счет увеличения ее активной концентрации. Исходя из приведенных данных, можно предположить, что самопроизвольный захват спермиями посторонней ДНК происходит за счет рецепторопосредованного эндоцитоза. Подтверждением сказанному могут служить блокировка поглощения ДНК хлороквином (см. табл. 1), кооперативность связывания ДНК с поверхностью спермиев [1] и факт более эффективного удержания длинных фрагментов ДНК по сравнению с короткими [19]. Возможно, экзогенная ДНК первоначально связывается с молекулами MHCII. Фактор IF-1 блокирует это взаимодействие, в свою очередь ассоциируя c рецептором МНСII. Далее, в результате латеральной диффузии МНСII взаимодействует с СD4 и передает ему ДНК. Вновь образовавшийся комплекс СD4/ДНК интернализуется клеткой путем эндоцитоза. В цитоплазме происходит высвобождение ДНК из части везикул, и она может проникнуть в ядро [20] и интегрировать в основание петель хроматина [21]. Оставшаяся ДНК в результате экзоцитоза возвращается в виде комплекса СD4/ДНК на поверхность спермия, где комплекс диссоциирует (рис. 2). Добавим, что ДМСО шунтирует путь проникновения ДНК в спермий. После осеменения крольчих спермиями, трансформированными плазмидой pRK3lacZ, мы обнаружили экспрессию бактериальной b-галактозидазы в функциональном слое эндометрия матки, что свидетельствует о проникновении в клетки поверхностного цилиндрического эпителия исходной ДНК. M. Cabrera и соавт. [22] преинкубировали спермии человека с ДНК вируса папилломы человека и затем инкубировали их с вылупившимися бластоцистами мыши. С помощью ПЦР-анализа экзогенная ДНК была идентифицирована в ВКМ и трофобласте бластоцист. Как же спермии передают экзогенную ДНК в клетки-мишени без пенетрации последних? Мы полагаем, что достаточно контакта между соседними клетками, при этом экзогенная ДНК представляется клетке-мишени в результате экзоцитоза в виде связанного комплекса рецептор/ДНК, и далее ДНК взаимодействует с последующим более аффинным рецептором на клетке-мишени, после чего вновь образовавшийся комплекс ДНК/белок интернализуется в клетку-мишень. В пользу предложенной гипотезы свидетельствует ряд фактов. Во-первых, модель (см. рис. 2) хорошо согласуется с 3-фазной кинетикой взаимодействия ДНК и сперматозоида: 1) адсорбция — взаимодействие с рецептором; 2) насыщение — интернализация комплекса рецептор/ДНК; 3) элиминация ДНК путем экзоцитоза. Во-вторых, последняя фаза взаимодействия (элиминация) проходит более активно при 37 °С, чем при 0 °С [2], что указывает на энергозависимость эндо- и экзоцитоза. В-третьих, модель показывает как ДНК сохраняется внутри сперматозоида во время его движения в репродуктивном тракте самки. Элиминация ДНК наступает через 60 мин после начала инкубирования [2]. За это время спермий способен достичь шейки матки. В-четвертых, часть поглощенной ДНК высвобождается из везикул и способна интегрировать в хроматин спермия [21] и/или эмбриона и потом может быть обнаружена у рожденных животных [6, 23, 24]. В-пятых, модель не противоречит данным по взаимодействию ДНК со сперматозоидами кролика, изложенными в настоящей работе (см. табл. 2) и, таким образом, является логически замкнутой. Вероятными кандидатами на роль рецепторов ДНК на спермиях кролика являются молекулы МНСII и CD4. Таким образом, представленные в работе данные свидетельствуют о реальной возможности инфицирования посторонними ДНК при использовании разбавленной спермы и недостатке ингибирующего фактора IF-1. Факт передачи экзогенной ДНК в удаленные клетки-мишени, дополненный моделью ее интернализации в спермий, может быть ключом к пониманию ряда репродуктивных патологий, а также является стимулом для разработки элегантной технологии генотерапии на основе подвижных векторов, т.е. мужских гамет. А.В. Кузнецов, С.А. Каурова*, И.В. Кузнецова Государственный научный центр прикладной микробиологии, Оболенск; *Институт биофизики клетки РАН, Пущино Авторы благодарны Э.Н. Гаховой за участие в обсуждении рукописи. Литература 1. Кузнецов А.В., Сигаева В.А., Кузнецова И.В., Щит И.Ю. Сперматозоиды кролика способны связывать чужеродную ДНК. Пробл репрод 1996; 1: 7–10. 2. Сигаева В.А., Кузнецова И.В., Кузнецов А.В. Связывание экзогенной ДНК сперматозоидами. Пробл репрод 1996; 2: 18–20. 3. Кузнецов А.В., Кузнецова И.В. Связывание экзогенной ДНК pRK3lacZ сперматозоидами кролика, ее перенос в ооциты и экспрессия в доимплантационных эмбрионах. Онтогенез 1995; 26(4): 300–309. 4. Кузнецова И.В., Кузнецов А.В., Сигаева В.А., Щит И.Ю. Использование сперматозоидов кролика в качестве вектора для чужеродной ДНК. Биотехнология 1993; 11–12: 2–5. 5. Кузнецов А.В., Кузнецова И.В., Народицкий Б.С., Гольдман И.Л., Эрнст Л.К. Способ введения чужеродной ДНК в сперматозоиды. Патент России: RU 94027663 А1, 21.07. 1994. 6. Кузнецов А.В., Жаданов А.Б., Кузнецова И.В., Щит И.Ю. Перколяция чужеродной ДНК в геном при оплодотворении. Пробл репрод 1998; 4(1): 38–43. 7. Щит И.Ю., Кузнецов А.В., Каурова С.А., Кузнецова И.В., Гусев В.В. Негативное действие экзогенной ДНК на оплодотворение и ранний эмбриогенез в опытах по опосредованному сперматозоидами переносу генов. Пробл репрод 1998; 4: 5—10. 8. Жаданов А.Б. Получение векторов для экспрессии чужеродных генов в трансгенных животных: Автореф. дис. ... канд биол наук. М 1991. 9. Kawai S., Nishizawa M. New procedure for DNA transfection with polycation and dimethyl sulfoxide. Mol Cell Biol 1984; 4: 6: 1172–1174. 10. Loke S.L., Stein С.А., Zhang X.H., Mori K., Nakanishi M., Subasinghe C., Cohen J.S., McNeckers L. Characterization of oligonucleotide transport into living cell. Proc Natl Acad Sci USA 1989; 86: 3474–3478. 11. Kiessling A.A., Crowell R.C., Connell R.S. Sperm-assosiated retroviruses in the mouse epididymis. Proc Natl Acad Sci USA 1987; 84: 8667–8671. 12. Dussaix E., Guetard D., Dauguet C., Dalmeida M., Auer J., Ellrodt A., Montagnier L., Auroux M. Spermatozoa as potential carriers of HIV. Research in Virology 1993; 144(6): 487–495. 13. Nuovo G.J., Becker J., Simsir A., Margiotta M., Khalife G., Shevchuk M. HIV-1 Nucleic acids localize to the spermatogonia and their progeny. Am J of Pathol 1994; 144(6): 1142–1148. 14. Lavitrano M., Maione В., Forte E., Francolini M., Sperandio S., Testi R., Spadafora C. The interaction of sperm cells with exogenous DNA: a role of CD4 and major histocompatibility complex class II molecules. Exp Cell Res 1997; 233(1): 56–62. 15. Wu G.M., Nose K., Mori E., Mori T. Binding of foreign DNA to mouse sperm mediated by its MHC class II structure. Am J Reprod Immunol 1990; 24: 120–126. 16. Atkinson P.W., Hines E.R., Beaton S., Matthaei K.I., Reed K.C., Bradley M.P. Association of exogenous DNA with cattle and insect spermatozoa in vitro. Mol Reprod Dev 1991; 29: 1–5. 17. Castro F.O., Hernandez О., Uliver C., Solano R., Milanes C., Aquilar A., Perez A., de Armas R., Herrera L., de la Fuente J. Introduction of foreign DNA into the spermatozoa of farm animals. Theriogenology 1990; 34(6): 1099–1110. 18. Zani M., Lavitrano M., French D., Lulli V., Maione B., Sperandio S., Spadafora C. The mechanism of binding of exogenous DNA to sperm cells: factors controlling the DNA uptake. Exp Cell Res 1995; 217: 57–64. 19. Lavitrano M., French D., Camaioni A., Zani M., Frati L., Spadafora C. The interaction between exogenous DNA and sperm cells. Mol Reprod Dev 1992; 31: 161–169. 20. Francolini M., Lavitrano M., Lamia C.L., French D., Frati L., Cotelli F., Spadafora C. Evidence for nuclear internalization of exogenous DNA into mammalian sperm cells. Mol Reprod Dev 1993; 34: 133–139. 21. Zoraqi G., Spadafora C. Integration of foreign DNA sequences into mouse sperm genome. DNA Cell Biol 1977; 16(3): 291–300. 22. Cabrera M., Chan P.J., Kalugdan Т.Н., King A. Transfection of the inner cell mass and lack of a unique DNA sequence affecting the uptake of exogenous DNA by sperm as shown by dideoxy sequencing analogues. J Assist Reprod Genet 1997; 14(2): 120–124. 23. Lavitrano M., Camaioni A., Fazio V.M., Doici S., Farace M.G., Spadafora C. Sperm cells as vectors for introducing foreign DNA into eggs: genetic transformation of mice. Cell 1989; 57: 717–723. 24. De la Fuente J., Castro F.O., Hernandez O., Guillen I., Ullver C., Solano R., Milanes C., Agullar A., Lleonart R., Martinez R., Perez A., de Armas R., Herrera L., Limonta J., Cabrera E., Herrera F. Sperm mediated foreign DNA transfer experiments in different species. Presented at Biotech. USA, Ramada Renaissance Tech. World, Washington, DC, November 27–29. 1990. |