Состояние репродуктивной системы у мужчин в условиях антиортостатической гипокинезии.
|
Введение
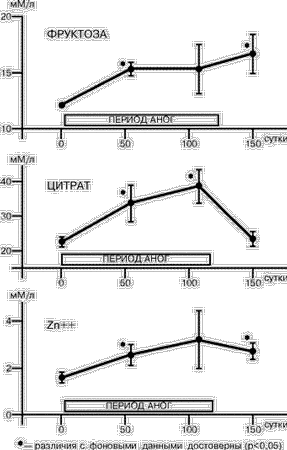
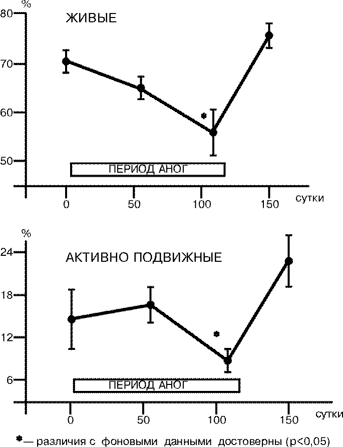
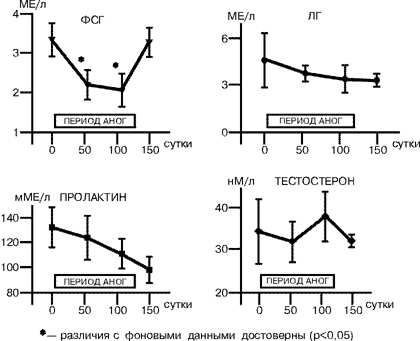
Длительное пребывание человека в условиях орбитального космического полета становится в наши дни все более распространенным видом деятельности, и профессия космонавта из “экзотической” превращается в привычную. Увеличение продолжительности космических полетов, долгосрочные проекты эксплуатации международных космических объектов наряду с задачами, связанными с поддержанием нормального состояния здоровья и сохранения работоспособности космонавтов и астронавтов во время полетов, ставят вопрос о необходимости изучения состояния репродуктивной функции у лиц данной профессии. Длительный постельный режим в антиортостатическом положении с углом наклона тела относительно горизонта –6° — антиортостатическая гипокинезия (АНОГ), является широко распространенным способом моделирования факторов космического полета (преимущественно эффектов невесомости) в наземных условиях. В практике здравоохранения длительный постельный режим, сопровождаемый неблагоприятными последствиями гипокинезии и гиподинамии, имеет место в клинике нервных болезней, сердечно-сосудистых заболеваний, травматологии и ряда других, а также, учитывая распространенность гиподинамии как социального явления, с ее последствиями сталкиваются врачи всех специальностей. В этой связи изучение репродуктивной функции в АНОГ представляется важным как для углубления наших теоретических знаний в области гравитационной физиологии и космической биологии, так и для решения прикладных задач практической медицины. Несмотря на актуальность проблемы, в литературе практически нет данных о влиянии длительного постельного режима в антиортостатическом положении тела на репродуктивную функцию, за исключением результатов изучения половой системы и функции воспроизводства у животных в условиях гипокинезии и иммобилизации [1, 2]. Настоящие исследования были проведены с целью изучения репродуктивной функции у мужчин во время 120-суточной АНОГ. Они являются логическим продолжением изучения этой важной проблемы после наземных исследований по оценке состояния репродуктивной системы у женщин, проведенных в ГНЦ РФ ИМБП в 1993–1994 гг. Материал и методы Всего в исследованиях приняли участие 12 здоровых мужчин-добровольцев в возрасте от 25 до 42 лет, 5 из которых составляли контрольную группу (продолжительность АНОГ — 120 суток без использования средств профилактики), а 7 других — находились в АНОГ 60 суток и использовали в качестве средства профилактики периодические дневные физические упражнения в специальном костюме, обеспечивавшем дополнительную нагрузку преимущественно на антигравитационную мускулатуру тела. Показатели сперматогенеза (СГ) определяли в пробах эякулята, полученных до начала (фон), на 50–60-е, 108–110-е сутки АНОГ и на 30-е сутки восстановительного периода. Эякулят был получен общепринятым способом при стандартных зрительных стимулах (3). Подсчет показателей и анализ результатов стандартных показателей эякулята для определения состояния СГ проводились с использованием метода световой микроскопии, в оценках следовали рекомендациям и нормативам ВОЗ [3]. Определение показателей гормонального статуса проводилось в пробах сыворотки крови, взятой в те же сроки АНОГ путем венепункции локтевой вены, натощак, в утренние часы. Методами радиоиммунологического и иммуноферментного анализа в пробах крови определяли концентрацию лютеинизирующего гормона (ЛГ), пролактина (ПРЛ), фолликулостимулирующего гормона (ФСГ) и тестостерона с использованием коммерческих тест-наборов фирм «CIS-International» (Франция) и «BIO-RAD» (США). Полученные первичные данные были проанализированы методами вариационной статистики, корреляционного и регрессионного анализа с использованием прикладных компьютерных программ SPSS и Systat (SPSS Inc.). Результаты и их обсуждение Данные, полученные в каждой подгруппе, существенно не различались, что позволило объединить их в одну группу. До начала постельного периода у всех обследованных добровольцев определяемые показатели не выходили за пределы физиологической нормы. Через два и, особенно, через три месяца пребывания в условиях АНОГ у всех обследуемых отмечалось увеличение концентрации фруктозы, цитрата и ионов цинка в эякуляте (рис.1) по сравнению с исходными показателями. Это свидетельствовало об увеличении секреторной активности предстательной железы и семенных пузырьков, которая должна была положительно влиять на жизнеспособность половых клеток, — известны данные научной медицинской литературы о высокой корреляции между концентрацией фруктозы и ионов цинка в эякуляте и фертильностью у мужчин [4, 5]. Однако в настоящих исследованиях наблюдалось снижение по сравнению с исходными (фоновыми) показателями и нормами ВОЗ процента живых (ЖС) и активно подвижных сперматозоидов (АПС) с одновременным увеличением количества морфологически измененных форм клеток и уменьшением объема эякулята (рис. 2), т.е. наличием признаков, свидетельствующих о снижении фертильности. Это сопровождалось падением концентрации ФСГ в крови на 55–60 и 108–110 сутки исследований и практически неизмененной концентрацией ЛГ и тестостерона (рис. 3). В то же время отмечалась тенденция к нарастающему снижению концентрации пролактина в крови, что косвенно отражало состояние дофаминергической системы организма в исследуемый период. Возможно, что изменения концентрации пролактина могли влиять на снижение фертильности, поскольку известно, что у мужчин этот гормон участвует в регуляции сперматогенеза и биосинтезе половых стероидов, отмечена связь между фертильностью, гипогонадотропной импотенцией и недостаточностью секреции пролактина [4–7].
Анализ взаимосвязи исследуемых переменных показал наличие достоверных корреляций между гонадотропными гормонами, что свидетельствовало о сохранности нормальных механизмов гормональной саморегуляции основных звеньев гипоталамо-гипофизарной системы в условиях АНОГ. Также положительные корреляционные связи были выявлены между отдельными показателями СГ, в частности, между ФСГ в крови, концентрацией фруктозы, количеством клеток сперматогенеза (КСГ) и объемом эякулята (r=0,387, p=0,007; r=0,463, p=0,001; r=0,420, p=0,003 соответственно); между ЖС, КСГ и концентpацией цитpата (r=0,4, p=0,006;r=0,36, p=0,039 соответственно). Эти особенности, с одной стороны, свидетельствовали о сохранности основных систем регуляции репродуктивной функции в условиях длительной АНОГ, а с другой — указывали на влияние других факторов (локального кровотока в малом тазу, локальной температуры тестикул, внутритканевых регуляторов репродукции и др.) в развитии выявленных изменений, что требует дальнейшего исследования. Отмечалась умеренная корреляция между количеством лейкоцитов и неподвижных сперматозоидов в пробах эякулята (r=0,39, р=0,006), что могло указывать на возможную роль в снижении фертильности в условиях АНОГ повышенной проницаемости гематотестикулярного барьера, приводящей к иммобилизации части зрелых сперматозоидов после непосредственного контакта в просвете семенных канальцев клеток крови с собственными антигенами (в данном случае сперматозоидами, не обладающими толерантностью). Оценивая полученные результаты, следует обратить внимание на следующее обстоятельство: группа обследуемых была составлена из мужчин, прошедших тщательный медицинский отбор, т.е. фактически здоровых людей с достаточно высоким индивидуальным уровнем резервных компенсаторных механизмов, и не предъявлявших жалоб на сексуальные расстройства. Необходимо отметить, что обнаруженные в процессе испытаний изменения сперматогенеза носили преходящий характер и нормализовались через месяц после окончания АНОГ, а количество живых и нормальных форм сперматозоидов даже превышали исходный уровень. Полученные нами результаты показывают необходимость разработки перспективной программы по изучению механизмов выявленных изменений, и факторов, обусловливающих индивидуальную устойчивость (или чувствительность) репродуктивной системы к действию комплекса экстремальных воздействий внешней среды, а также разработки системы соответствующих лечебно-профилактических мероприятий, повышающих устойчивость репродуктивной системы. Вместе с тем полученные нами результаты в известной степени могут быть использованы для сравнения групп мужчин, находящихся в условиях вынужденной длительной половой абстиненции и гиподинамии. Например, зимовщики полярных станций, или заключенные, находящиеся в изолированных камерах, или травмированные с повреждением позвоночника, или космонавты, пребывающие в длительном полете, и др. Выводы Полученные результаты показали, что в условиях гипокинезии у мужчин сохранялись нормальные значения концентрации половых гормонов в крови, объема семенной жидкости и общего количества сперматозоидов по сравнению с исходными данными и нормами ВОЗ. При этом возрастала секреторная активность семенных пузырьков и предстательной железы. Вместе с тем уменьшались подвижность и жизнеспособность половых клеток, что может указывать на снижение фертильности. И.А. Ничипорук, В.В. Евдокимов*, А.Г. Гончарова, В.И. Ерасова*, О.А. Смирнов, Г.Ю. Васильева, Д.В.Воробьев Государственный научный центр Российской Федерации — Институт медико-биологических проблем; * НИИ урологии Минздрава Российской Федерации, Москва Литература 1. Гончаров Н.П., Воронцов В.И., Кация Г.В. и др. Вест АМН СССР 1977; 13–20. 2. Katsiia G.V., Todua T.N., Gorlushkin V.M. and coil. Effect of immobilization stress on gonadotropic function of the hypophysis in male hamadryals baboons. Biul Eksp Biol Med 1989; Feb 107: 2: 231–234. 3. Руководство ВОЗ по лабораторному исследованию эякулята и взаимодействия спермы с цервикальной слизью. 3-е издание, Женева, 1992. 4. Schambach Н., Knappe G., Carol W. (Hrsg.) Hormon-therapie in der Praxis. VEB Verlag. 1990. 5. Старкова H.T. Фармакотерапия в эндокринологии. M.: Медицина 1989; 288. 6. Wenner R., Braun P. Prolactin-dependent Sexual Disfunction in the Male. Basel: Sandoz LTD, 1983. 7. Macleod R.M., Thorner M.D., Scapanini U. (Eds.) Prolactin. Basic and Clinical Correlates. Berlin-Heidelberg-New York-Tokyo, Springer, 1985. |