Восстановление фертильности после оперативной лапароскопии у женщин с синдромом поликистозных яичник.
|
Синдром поликистозных яичников (СПКЯ) одна из наиболее частых причин нарушения менструальной и генеративной функции, встречающаяся у 10–15% женщин репродуктивного возраста и у 73–75% пациенток с ановуляторным бесплодием [3, 6, 7].
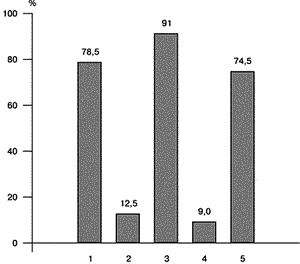
До настоящего времени продолжаются исследования по вопросам патогенеза, диагностики и лечения СПКЯ. В последнее десятилетие расширился арсенал препаратов для консервативной стимуляции овуляции. В частности, в клинической практике широко используются препараты “чистого” ФСГ, которые более предпочтительны для стимуляции овуляции у женщин с высоким уровнем ЛГ, что часто имеет место при с СПКЯ [5]. Модифицировано множество схем лечения гонадотропинами, в том числе с предварительным введением ГнРГ с целью десенситизации гипофиза. Однако это не привело к ожидаемым результатам, т.е. увеличению частоты наступления овуляции и беременности и, самое главное, снижению риска развития многоплодной беременности и СГЯ [5]. В связи с чем в последние годы возрос интерес к хирургическим методам лечения СПКЯ, тем более что совершенствование эндоскопической техники способствует минимальному инвазивному вмешательству и снижает риск образования спаек. Большинство клиницистов отдают предпочтение лапароскопическому доступу для проведения резекции поликистозных яичников, так как при традиционной лапаротомии высок риск развития спаечного процесса, снижающего частоту наступления беременности [1, 10]. Целью настоящего исследования явилось определение эффективности лапароскопической резекции яичников в восстановлении репродуктивной функции у женщин с СПКЯ. Материал и методы Обследовано 98 пациенток в возрасте от 17 до 38 лет (средний возраст 24,1±1,3 года). Клиническое обследование включало изучение данных анамнеза, характера становления и нарушения менструальной функции. При объективном исследовании избыточная масса тела оценивалась по индексу массы тела (ИМТ), степень выраженности гирсутизма – по Baron (I – легкая, II – средняя, III – тяжелая). Гормональные исследования включали определение ЛГ, ФСГ, пролактина (ПРЛ) и тестостерона (Т) в плазме крови на 5–7-й день самостоятельного (индуцированного) менструального цикла или на фоне аменореи. Радиоиммунологические исследования гормонов крови проводились РИА наборами фирмы “Иммунотех” (Прага, Чехия) в биохимической лаборатории Онкологического научного центра РАМН. Ультразвуковое исследование (УЗИ) органов малого таза выполнялось при помощи аппарата фирмы “Combison” с использованием трансвагинального и трансабдоминального датчиков с частотой 5 и 7 МГц. При этом определяли размеры яичников, их объем и толщину эндометрия, сопутствующую патологию матки (миома, аденомиоз). Диагностическими ультразвуковыми критериями поликистозных яичников явились увеличение объема яичников более 9 мм3 за счет стромы, занимающей примерно 25% объема; наличие более 8–10 атретичных фолликулов диаметром менее 10 мм, расположенных чаще периферически по отношению к гиперэхогенной строме [4, 8, 9]. Показанием к лапароскопии у всех пациенток явилась неэффективность стимуляции овуляции консервативными методами, а также отсутствие беременности при наличии овуляторных циклов на фоне терапии кломифеном. Лапароскопия проводилась с использованием аппаратуры и инструментов фирм “Storz” и “Wizap” по общепринятой методике под общей анестезией: после наложения пневмоперитонеума вводился основной и два дополнительных троакара. Всем пациенткам производилась клиновидная резекция яичников и у части обследованных другие оперативные вмешательства в зависимости от выявленной сопутствующей патологии органов малого таза. С целью гемостаза использовалась моно- и биполярная коагуляция. Технических сложностей не было, кровопотеря во время операции минимальная; послеоперационных осложнений также не отмечено. Пациентки выписывались в удовлетворительном состоянии на 2-е сутки после операции. Ранним критерием эффективности лапароскопической резекции яичников явилось наличие менструального кровотечения в течение 3–14 дней после операции, а также тестированная по базальной температуре овуляция через 2–4 нед после операции. В дальнейшем критериями эффективности считали восстановление регулярных менструальных циклов; овуляцию, оцениваемую по базальной температуре, данные УЗИ и наступление беременности как показатель восстановления генеративной функции. При недостаточности лютеиновой фазы или ановуляции в течение 2–3 циклов после операции назначалась стимуляция овуляции кломифеном по общепринятой схеме. Анализ результатов исследования проводился с помощью критерия Стьюдента. Различия между вариационными рядами считались достоверными при р меньше 0,05. Результаты и обсуждение Основной жалобой у всех пациенток было бесплодие (первичное – у 98,7%, вторичное – у 1,3%). Следует отметить, что вторичное бесплодие наблюдалось у пациенток, в прошлом лечившихся от эндокринного бесплодия, т.е. беременности были индуцированные. Помимо бесплодия, 27 (27,6%) пациенток жаловались на гирсутизм. Несмотря на сопутствующее ожирение (у 39,9% обследованных), избыточная масса беспокоила только 11 женщин. При анализе данных анамнеза возраст менархе не отличался от такового в популяции и составил в среднем 12,9±1,7 года. Нарушение менструального цикла у 79 (80,6%) отмечалось с периода менархе, у остальных 19 (19,4%) – после различных стрессов (операции, травмы, нейроинфекции), а также начала половой жизни. Нарушение менструального цикла у подавляющего большинства женщин (у 61,6%) протекало по типу олигоменореи, аменорея II отмечена у 31,4%, дисфункциональные маточные кровотечения – у 4,2%, неустойчивый менструальный цикл – у 2,8%. ИМТ в пределах нормы (20–26) был у 52,6%, свыше 26 – у 44,9% и свыше 30 – у 2,5% обследованных. Следует отметить, что значения ИМТ даны после проведения терапии, направленной на нормализацию массы тела и метаболических нарушений (диета, физические нагрузки, регуляторы нейромедиаторного обмена ЦНС и медикаментозная терапия инсулинорезистентности). В течение 3–6 мес до операции у пациенток с ожирением удалось добиться снижения массы тела на 10–28 кг (в среднем на 12±1,4 кг). Но несмотря на терапию метаболических нарушений, сохранялись ановуляция и резистентность к кломифену. Степень выраженности гирсутизма: I – у 29,1%, II – у 52,8% и III – у 18,1%. У всех пациенток по данным тестов функциональной диагностики и УЗИ имелась ановуляция. Повышенный уровень ЛГ (более 10 мМЕ/л) отмечен у 69,4% пациенток, уровень ФСГ был в пределах нормы. Увеличение отношения ЛГ/ФСГ больше 2,5 отмечено у 57,8% обследованных, ЛГ/ФСГ больше 2 был у 20,3% пациенток, у остальных 21,9% типичного для СПКЯ повышения отношения ЛГ/ФСГ не отмечалось. Эти данные представляют определенный интерес, поскольку до настоящего времени дискутируются вопросы гормональных критериев диагностики СПКЯ [6–9]. Длительное время считалось, что основным критерием диагностики является увеличение отношения ЛГ/ФСГ больше 3 [3]. В настоящее время большинство клиницистов к гормональным критериям диагностики СПКЯ относят увеличение отношения ЛГ/ФСГ больше 2,5 [7, 9]. Мы также считаем, что для женщин с СПКЯ типично отношение ЛГ/ФСГ больше 2,5. Интерес представляет тот факт, что повышенный уровень ЛГ и отношение ЛГ/ФСГ больше 3 и 2,5 чаще наблюдались у пациенток без ожирения по сравнению с женщинами с ожирением (62,9 и 38,3% соответственно; различия статистически достоверны, р меньше 0,05). Уровень Т у подавляющего большинства обследованных (у 72,7%) был выше нормы, составляя в среднем 3,1± 0,45 нмоль/л. Незначительное повышение уровня ПРЛ чаще наблюдалось у женщин с ожирением по сравнению с пациентками без ожирения (21,3 и 16,7% соответственно; р больше 0,05). Этим пациенткам дополнительно назначался парлодел в небольших дозировках (1,25–2,5 мг в сутки). При УЗИ с использованием трансвагинального датчика у всех пациенток было выявлено увеличение объема яичников в среднем до 15,6±1,9 мм3, за счет стромы, множество анэхогенных атретичных фолликулов диаметром 6–8 мм, расположенных у большинства обследованных периферически по отношению к гиперэхогенной строме. Толщина эндометрия соответствовала I фазе цикла, составляя в среднем 7–8 мм. Миома матки небольших размеров (субсерозные и интрамуральные узлы от 1 до 2 см в диаметре) выявлена у 8 (8,1%) обследованных, аденомиоз I–II степени – у 6 (6,1%). При лапароскопии у всех пациенток диагноз СПКЯ был подтвержден. Типичная картина увеличенных яичников с гладкой, плотной капсулой, стромальной гиперплазией и периферически раположенными фолликулами диаметром до 5–8 мм выявлена у 56,6% обследованных. У остальных женщин также отмечено значительное увеличение яичников за счет стромы, но наблюдалось диффузное расположение атретичных фолликулов диаметром до 10 мм по отношению к гиперплазированной строме. Сопутствующая патология, выявленная при лапароскопии у 32 (32,7%) пациенток, была следующая: спаечный процесс (плоскостные спайки) – у 12 (12,2%), миомы матки небольших размеров (субсерозные или интрамурально-субсерозные) диаметром до 1,5–2 см – у 8 (8,2%), наружный эндометриоз I степени распространенности – у 5 (5,1%), фибромы яичников – у 4 (4,1%) и параовариальные кисты – у 3 (3,1%) обследованных. Следует отметить, что у подавляющего большинства пациенток консервативная терапия СПКЯ была эффективна для индукции овуляции, но беременности не наступало. В послеоперационном периоде, учитывая наибольший эффект стимуляции овуляции в первые 6 мес, всем пациенткам рекомендовали не предохраняться от беременности. Критерием эффективности хирургической стимуляции овуляции явилось восстановление овуляторных менструальных циклов у 77 (78,5%) обследованных, у остальных тестирована недостаточность лютеиновой фазы или ановуляция, что потребовало дополнительного назначения кломифена. В результате удалось добиться овуляции еще у 12 (12,5%) пациенток. Суммарный эффект индукции овуляции повысился до 91% (см. рисунок).
Отсутствие эффекта у 9 пациенток в возрасте 35–38 лет можно объяснить длительностью заболевания, т.е. хронической ановуляцией с периода менархе. В анамнезе всех этих пациенток проводилась гормональная терапия эстроген-гестагенными препаратами, стимуляция овуляции кломифеном, гонадотропинами в течение длительного времени без эффекта. В предоперационном периоде на фоне коррекции метаболических нарушений нам удалось снизить ИМТ с 32–34 до 26–27. Но несмотря на это, резекция яичников оказалась эффективной лишь для восстановления менструального цикла, но не овуляции, даже с дополнительным назначением кломифена или гонадотропинов. При повторном определении уровня гормонов у этих пациенток отмечена нормализация показателей ЛГ, ФСГ, Т и ПРЛ. В литературе имеются сообщения о снижении чувствительности стероидогенных структур длительно существующих поликистозных яичников к гонадотропной стимуляции [2]. Как известно, механизм стимуляции овуляции при клиновидной резекции основан на нормализации гонадотропной функции гипофиза в результате уменьшения объема андрогенсекретирующей стромы поликистозных яичников [3]. При этом снижается синтез не только андрогенов, но и экстрагонадных эстрогенов, воздействующих на гипоталамо-гипофизарную систему и повышающих чувствительность гипофиза к ГнРГ. При сохраненной чувствительности гормонопродуцирующих структур яичников в ответ на нормализацию гонадотропной стимуляции происходит восстановление фолликулогенеза, т.е. рост и созревание доминантного фолликула и овуляция. Отсутствие реакции яичников в ответ на адекватную гонадотропную стимуляцию можно объяснить нарушением механизмов аутопаракринной регуляции фолликулогенеза в результате длительной хронической ановуляции. Многочисленными исследованиями показана эффективность клиновидной резекции яичников в восстановлении овуляторных менструальных циклов в течение года (до 82–93%), в дальнейшем этот процент снижается (до 61–73) [1, 5, 9, 10]. Однако восстановление фертильности представляет определенные трудности, что может быть связано с сопуствующей патологией органов малого таза [1], а также мужским фактором бесплодного брака, частота которого в структуре бесплодного брака имеет тенденцию к повышению. В результате лечения беременность в течение 6 мес наступила у 52 (53,1%) пациенток, в течение последующих 6–18 мес еще у 21 (21,4%), в том числе на фоне кломифена и терапии метаболических нарушений. Суммарный процент беременностей в течение 12–18 мес после операции составил 74,5% (см. рисунок). Отсутствие беременности у 25 (25,5%) пациенток можно объяснить: у 9 женщин большой длительностью ановуляции, у 16 женщин, несмотря на нормализацию овуляторных циклов, – сопутствующей патологией органов малого таза (у 9), мужским фактором (у 3), возможным постоперационным спаечным процессом (у 4), в дальнейшем этим женщинам были рекомендованы вспомогательные методы репродукции. Выводы 1. В результате проведенного исследования показана высокая эффективность лапароскопической клиновидной резекции яичников у женщин с СПКЯ. Восстановление менструальной функции и овуляции отмечено у 91%, а генеративной – у 74,5% обследованных. 2. В предоперационном периоде коррекция метаболических нарушений на фоне диеты и/или медикаментозной терапии повышает эффективность хирургической стимуляции овуляции. 3. При выявлении ановуляции или недостаточности лютеиновой фазы необходимо раннее (в первые 2–3 мес после лапароскопии) назначение стимуляторов овуляции (кломифена), что повышает частоту восстановления репродуктивной функции. 4. У женщин с СПКЯ отсутствие беременности при наличии овуляторных циклов в ответ на стимуляцию овуляции свидетельствует о сопутствующем перитонеальном факторе бесплодия, что требует лапароскопического обследования. Так, по нашим данным, у 32,3% обследованных женщин с СПКЯ при лапароскопии выявлена сопутствующая патология малого таза. 5. Длительная, неэффективная консервативная терапия СПКЯ снижает возможность восстановления фертильности после хирургического лечения. М.А. Геворкян, И.Б. Манухин, М.А. Царькова, М.Д. Городецкая Кафедра акушерства и гинекологии лечебного факультета Московского государственного медико-стоматологического университета Литература 1. Гаспаров А.С. Роль лапароскопии в диагностике болезни поликистозных яичников (БПКЯ) и сопутствующей патологии органов малого таза. Пробл репрод 1995; 2: 34–35. 2. Рубченко Т.И. Функциональное состояние яичников и выбор тактики ведения больных нейроэндокринным синдромом с нарушением репродуктивной функции. Автореф. дис. ... канд. мед. наук. М 1988. 3. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. М 1997; 189–207. 4. Стрижаков А.Н., Давыдов А.И. Клиническая трансвагинальная эхография. М 1997; 50–92. 5. Balen A.H. Новые концепции в индукции овуляции. Пробл эндокринол 1998; 4:31–35. 6. Balen A.H., Conway G.S., Kaltsas G., Techatraisak K., Manning P. J., West C., Jacohs H.S. Polycystic ovary syndrome: the spectrum of the disorder in 1741 patient. Hum Reprod 1995; 10: 21: 107–2111. 7. Dunaif A., Givens J.R., Haseltine F., Merriam G.R. The Polycystic Ovary Syndrome.Book. Oxford-London-Edinburgh 1992; 1–384. 8. Donesky B. Advances in Polycystic Ovary Disease. Rochester. Minnesota 1996; 126. 9. Dewaily D. Definition and significance of polycystic ovaries. Baillier. Clin Obstet Gynecol 1997; 11(2):349–368. 10. Liguori G., Tolino A., Moccia G., Scognamiglio G., Nappi C. Laparoscopic ovarian treatment in infertile patients with polycystic ovarian syndrome (PCOS): endocrine changes and clinical outcome. Gynec Endocrinol 1996; 10(4): 257–264. |