Метаболические нарушения у больных с синдромом поликистозных яичников.
|
Синдром поликистозных яичников (СПКЯ) является наиболее частой причиной ановуляции и характеризуется нарушением менструального цикла в сочетании с клиническими и/или биохимическими проявлениями гиперандрогении и эхографическими признаками поликистозных яичников [2, 8, 10].
Несмотря на многочисленные клинические и экспериментальные исследования, механизмы патогенеза СПКЯ до конца не изучены. В последние годы появились данные о метаболических нарушениях у больных с СПКЯ. И эта проблема в настоящее время все больше привлекает внимание клиницистов и исследователей, поскольку речь идет о развитии гипергликемии и дислипидемии и связанных с ними таких заболеваний, как инсулиннезависимый сахарный диабет (ИНСД), гипертензия и сердечно-сосудистые заболевания (ССЗ). Причем у женщин с СПКЯ эти заболевания манифестируют в относительно молодом возрасте - на 3-4-м десятилетии жизни [12, 17]. Так, было показано, что при СПКЯ часто наблюдается инсулинорезистентность (ИР), т.е. снижение инсулинзависимой утилизации глюкозы периферическими тканями [14]. Результатом ИР является гиперинсулинемия (ГИ), играющая важную роль в синтезе андрогенов яичниками. По современным представлениям, синтез андрогенов в в клетках теки и стромы яичников происходит под влиянием ЛГ. Синергичное ему действие оказывают инсулин и инсулиноподобный фактор роста-1, активирующие фермент Р450с17a, участвующий в синтезе тестостерона. Понятно, что резистентность к инсулину и, как следствие, ГИ играют важную роль в избыточном образовании андрогенов и патофизиологии СПКЯ [6]. Впервые о сочетании гиперандрогении и ИР при СПКЯ сообщено Q. Burghen и соавт. [5]. Это способствовало развитию гипотезы о том, что ожирение и ГИ должны играть основную роль в патогенезе СПКЯ у пациенток с ИР [14]. Однако умеренная ГИ отмечается также и у худых пациенток с СПКЯ [13, 15]. Следовательно, ожирение может быть способствующим, но не основным фактором в развитии ИР при СПКЯ. При ИР нарушается утилизация глюкозы периферическими тканями (прежде всего мышцами), что приводит к компенсаторной ГИ, которая поддерживает нормальный уровень глюкозы в крови. Если же гиперфункции b-клеток поджелудочной железы не в состоянии поддерживать нормогликемию, возникает состояние относительной недостаточности инсулина, что клинически проявляется гипергликемией, т.е. нарушением толерантности к глюкозе и развитием ИНСД [4]. Поэтому ранним проявлением ИР является повышение стимулированного глюкозой уровня инсулина. Нарушение толерантности к глюкозе (НТГ) возникает в том случае, когда стимулированная ГИ не снижает уровень глюкозы до нормальных значений через 2 ч после проведения глюкозотолерантного теста (ГТТ). Данные о частоте ИР при СПКЯ достаточно противоречивы, что связано во многом с методами определения ГИ. Кроме того, изучаемые популяции не всегда сопоставимы в связи с гетерогенностью клинических, эндокринных и морфологических критериев диагностики СПКЯ. Целью исследования явилось определение клинических и эндокринно-метаболических проявлений ИР, а также частоты ГИ и НТГ у пациенток с СПКЯ. Материал и методы Обследовано 139 пациенток с СПКЯ. Возраст от 18 до 38 лет (средний возраст 27,3±1,5 года). В зависимости от индекса массы тела (ИМТ) выделены 2 группы: 1-я группа - 67 пациенток с нормальной массой тела (ИМТ меньше 25), 2-я группа - 72 пациентки с ожирением (ИМТ больше 26). Кроме того, в исследование включены 20 здоровых женщин репродуктивного возраста (средний возраст 26,0±0,4 года) с нормальной массой тела (ИМТ меньше 25) и 20 - с ожирением (ИМТ больше 26). Клиническое обследование включало изучение данных анамнеза, характера становления и нарушения менструальной функции. При объективном исследовании избыточная масса тела оценивалась по ИМТ, тип ожирения по отношению окружности талии к окружности бедер (Т/Б). Для мужского типа ожирения характерно значение данного индекса более 0,85, а для женского типа - меньше 0,85. Степень выраженности гирсутизма оценивалась по шкале Ферримана-Голвея. Гормональные исследования включали определение уровня ЛГ, ФСГ, пролактина, общего тестостерона (Т), дегидроэпиандростерона сульфата (ДГЭА-С), кортизола в плазме крови на 5-7-й день самостоятельного или индуцированного менструального цикла. Исследование гормонов крови проводилось методом РИА наборами фирмы "Иммунотех" (Чехия) в биохимической лаборатории Онкологического научного центра РАМН. ГИ и НТГ выявляли на основании определения базальных и стимулированных концентраций инсулина и глюкозы при проведении ГТТ. Кровь брали натощак и каждые 30 мин после приема 75-100 г глюкозы (в зависимости от ИМТ). Ультразвуковое исследование (УЗИ) органов малого таза проводилось при помощи аппарата фирмы "Combison" с использованием трансвагинального и трансабдоминального датчиков с частотой 5 и 7 МГц. При этом определялись размеры яичников, их объем и толщина эндометрия. Диагностическими ультразвуковыми критериями поликистозных изменений в яичниках явились увеличение объема яичников более 9 мм3 за счет гиперэхогенной стромы, наличие более 10 анэхогенных фолликулов диаметром менее 10 мм, расположенных диффузно или периферически по отношению к строме [3]. Критериями диагностики СПКЯ явились нарушение менструального цикла с периода менархе, хроническая ановуляция, клинические (гирсутизм) и/или биохимические (повышение уровня общего Т в крови) проявления гиперандрогении, эхографические признаки поликистозных изменений в яичниках, данные лапароскопии и гистологического исследования ткани яичников. Статистический анализ результатов исследования проводился с помощью коэффициента Стьюдента. Различия между вариационными рядами считались достоверными при p меньше 0,05. Результаты и обсуждение Частота ожирения среди обследованных нами больных СПКЯ составила 51,8%. У всех пациенток нарушение менструального цикла, гирсутизм, а у больных ожирением избыточная масса тела были с периода менархе, что является важным клиническим признаком СПКЯ. Нарушения менструального цикла по типу олигоменореи наблюдались у 69,2 и 62,4% пациенток 1-й и 2-й группы, по типу вторичной аменореи - соответственно у 26,2 и 31,2%. Трансвагинальная эхография выявила признаки поликистозных яичников у всех пациенток; объем яичников в исследуемой группе был достоверно больше по сравнению с контролем и составил 23,6±2,5 и 6,4±1,9 см3 соответственно. В зависимости от расположения анэхогенных фолликулов по отношению к гиперэхогенной строме выявлены 2 типа поликистозных яичников: I тип характеризовался диффузным, а II - периферическим (подкапсулярным) расположением фолликулов. Результаты гормональных исследований выявили наиболее типичные биохимические критерии поликистозных яичников, независящие от ИМТ: повышение уровня ЛГ больше 10 МЕ/л у 67,5% больных, увеличение отношения ЛГ/ФСГ более 2,5 - у 72,3% пациенток и повышение концентрации общего Т более 2,5 нмоль/л - у 63,2% больных. ГИ и ИР определяли на основании данных ГТТ. Изменение уровня глюкозы и инсулина в процессе проведения ГТТ отражены на рис. 1. На основании этих результатов выделены 2 подгруппы обследованных: с нормоинсулинемией (НИ) и ГИ (см. таблицу). В этой же таблице представлены основные клинические и эндокринологические характеристики пациенток с НИ и ГИ с целью выявления патогномоничных признаков ИР у больных с СПКЯ.
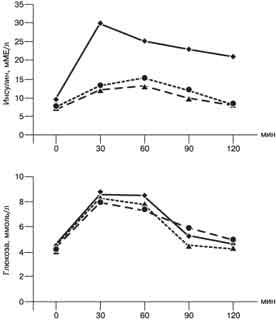
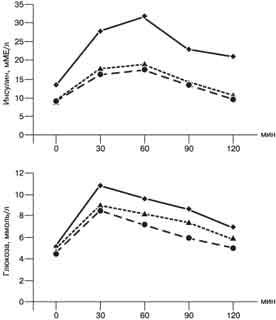
Рис. 1. Результаты ГТГ у больных СПКЯ без ожирения. (а) и с ожирением (б). Анализ полученных результатов показал, что ГИ и ИР достоверно чаще наблюдались у пациенток с ожирением. ГИ отмечалась у 43,3 и 80,6% больных 1-й и 2-й групп соответственно (p меньше 0,01). Базальный уровень инсулина у пациенток с ожирением и ГИ несколько выше, чем при НИ и нормальной массе тела. У больных с ГИ независимо от массы тела достоверно чаще выявляли выраженный гирсутизм (гирсутное число больше 25), нарушение менструального цикла по типу вторичной аменореи (p меньше 0,01). Среди пациенток с ожирением ГИ достоверно чаще выявлялась при мужском типе распределения жировой ткани (p меньше 0,05). Такой клинический признак ГИ и ИР, как "нигроидный акантоз" (гиперпигментированные участки кожи в местах трения и складок), отмечался только у 24 (41,4%) больных с мужским типом ожирения и ГИ. Возраст и, следовательно, длительность ановуляции у больных 1-й и 2-й групп с НИ и ГИ были примерно одинаковыми. Этот факт представляет определенный интерес и доказывает первичность ИР и ГИ, которые усугубляют клинические и эндокринологические проявления СПКЯ. Уровень ЛГ у пациенток с ГИ достоверно выше (p меньше 0,05), чем у больных с НИ, и не зависит от ожирения, что свидетельствует о роли инсулина в нарушении гонадотропной функции при СПКЯ. Вероятно, инсулин усугубляет хроническое повышение базального уровня ЛГ путем повышения чувствительности гипофиза к гонадолиберину [15]. Содержание общего Т у пациенток с ГИ также достоверно (p меньше 0,05) выше, чем у больных с НИ, что объясняется более выраженной продукцией андрогенов в результате усиления инсулином ЛГ-зависимого синтеза Т в текаклетках поликистозных яичников и экстрагонадного - в жировой ткани [6]. Содержание ДГЭА-С и кортизола достоверно выше только у пациенток с ГИ и ожирением (p меньше 0,05), что свидетельствует об активации гипоталамо-гипофизарно-надпочечниковой системы у больных с СПКЯ и ожирением. Анализ результатов консервативной стимуляции овуляции выявил у подавляющего большинства пациенток с ГИ независимо от массы тела резистентность к кломифену. У пациенток с ГИ независимо от массы тела достоверно чаще при УЗИ выявлялся II тип поликистозных яичников - периферическое расположение маленьких фолликулов по отношению к строме (p меньше 0,01). Эти данные могут свидетельствовать о более выраженных пролиферативных процессах в поликистозных яичниках на фоне ГИ. Известно, что инсулин не только способствует избыточной продукции андрогенов, но и активирует митогенную активность различных факторов роста: эпидермального, сосудистого эндотелиального и др. [11, 16]. Возможно, синергичный эффект инсулина, андрогенов и факторов роста играет важную роль в гиперплазии центральной стромы и текаклеток, что клинически проявляется усилением гирсутизма, нарушением менструального цикла по типу вторичной аменореи и резистентностью к терапии кломифеном. Итак, ГИ и ИР у больных с СПКЯ нами выявлены на основании повышения уровня стимулированного глюкозой инсулина у 43,3 и 80,6% пациенток с нормальной массой тела и ожирением соответственно (рис. 2).
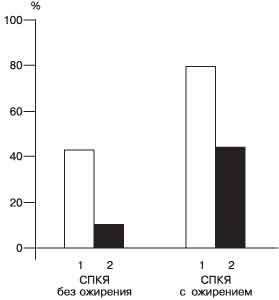
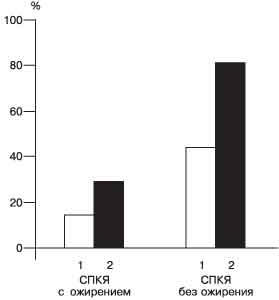
Рис. 2. Частота ГИ (1) и НТГ (2) у больных с СПКЯ. Некоторые исследователи в качестве критерия диагностики ИР и ГИ используют отношение базальных уровней инсулина и глюкозы, которое при этой патологии должно быть более 3 [1]. Мы сравнили информативность этих методик. Так, до проведения ГТТ средний базальный уровень инсулина был 9,4±1,8 и 13,2±0,9 мМЕ/л у 29 и 58 пациенток с ГИ в 1-й и 2-й группе соответственно. Уровень глюкозы был примерно одинаковым и составил в среднем 4,7±0,8 и 5,1±0,3 ммоль/л соответственно. Поэтому отношение инсулин/глюкоза даже у пациенток с ожирением не превышало 3. При использовании данного индекса ГИ диагностирована только у 10 (14,9%) из 67 и 21 (29,2%) из 72 пациенток с ГИ в 1-й и 2-й группе соответственно. Тогда как проведение ГТТ позволило выявить ИР и ГИ у 43,3 и 80,6% пациенток в 1-й и 2-й группах соответственно. Поэтому диагностика ГИ и ИР возможна только по определению не базального, а стимулированного глюкозой уровня инсулина. Сравнительная диагностическая значимость данных тестов в диагностике ГИ и ИР представлена на рис. 3. Однако широко в практике эта методика применяться не может, поэтому мы попытались выделить наиболее характерные клинические и эндокринологические признаки ГИ и ИР у пациенток с СПКЯ и ГИ, наличие которых требует проведения ГТТ.
Рис. 3. Информативность индекса инсулин/глюкоза (1) и глюкозотолерантного теста (2) в выявлении гиперинсулинемии. Таким образом, для ГИ и ИР у больных с СПКЯ характерно наличие: · выраженного гирсутизма (гирсутное число больше 25), · мужского типа ожирения (Т/Б больше 0,85), · "нигроидного акантоза", · вторичной аменореи, · II типа поликистозных яичников - периферическое расположение фолликулов по отношению к строме, · резистентности к кломифену. Если ГИ и ИР являются уникальными признаками СПКЯ независимо от ожирения, то НТГ и развитие ИНСД при СПКЯ наблюдаются реже. Из результатов настоящего исследования следует, что НТГ выявлено только у 7 (10,4%) из 67 пациенток с СПКЯ без ожирения и у большинства пациенток с ожирением - у 32 (44,4%) из 72. Все пациентки с ожирением и интолерантностью к глюкозе были в возрасте старше 30 лет. Эти данные показывают, что ГИ и ИР являются уникальными признаками СПКЯ и не всегда сопровождаются нарушением толерантости к глюкозе, риск которой повышается соответственно возрасту. Следует отметить, что у 7 пациенток с нормальной массой тела и интолерантностью к глюкозе наследственность была отягощена по ИНСД, что может свидетельствовать о генетически обусловленном нарушении функции b-клеток поджелудочной железы и ИР. Кроме того, можно полагать, что ГИ является следствием не только ИР, но и нарушения метаболизма инсулина в печени [9]. У пациенток с избыточной массой тела ГИ и СПКЯ дают синергичный эффект, следствием которого являются более выраженная степень ИР с нарушением толерантности к глюкозе и высокий риск развития ИНСД [7]. Выводы
Таблица 1. Клиническая, эндокринологическая и метаболическая характеристика обследованных пациенток с НИ и ГИ
Примечание. В скобках - процент М.А. Геворкян, И.Б. Манухин, Н.Е. Кушлинский, О.Б. Кухаркина Кафедра акушерства и гинекологии лечебного факультета с курсом ФПДО МГМСУ, Москва Литература 1. Овсянникова Т.В., Демидова И.Ю., Фанченко Н.Д., Бурлев В.А., Сперанская Н.В., Глазкова О.И., Кетиладзе Т.М. Метаболические нарушения у пациенток с хронической ановуляцией и гиперандрогенией. Пробл репрод 1999; 2: 34-38. 2. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. М 1997; 188-206. 3. Стрижаков А.Н., Давыдов А.И. Клиническая трансвагинальная эхография. М 1997; 50-92. 4. Сунцов Ю.И., Кудрякова С.В. Эпидемиология нарушенной толерантности к глюкозе. Пробл эндокринол 1999; 2: 48-52. 5. Burghen G.A., Givens J.R., Kitabchi A.Е. Сorrelation of hyperandrogenism with hyperinsulinism in polycystic ovarian disease. J Clin Endocrinol Metab 1980; 50: 113-116. 6. Dunaif A. Insulin resistance and the polycystic ovary syndrome: mechanism and implications for pathogenesis. Endocrinol Rev 1997; 6: 774-800. 7. Ehrmann D.A., Barnes R.B., Rosenfield R.L., Cavaghan M.K., Imperial J. Prevalence of impaired glucose tolerance and diabetes in women with polycystic ovary syndrome. Diabetes Care 1999; 22: 1: 141-146. 8. Fox R., Corrigan E., Thomas P.A., Hull M.G. The diagnosis of polycystic ovaries in women with oligo-amenorrhoea: predictive poweer of endocrine tests. Clin Endocrinol 1991; 34: 127-31. 9. Fulghesu A.M., Ciampelli M., Guido M., Murgia F., Caruso A., Mansuco S., Lanzone A. Role of Opioid Tone in the Pathophysiology of Hyperinsulinemia and Insulin Resistance in Polycystic Ovarian Disease. Metabolism 1998; 47: 2: 158-162. 10. Guzick D. Polycystic ovary syndrome: Symptomatology, pathophisiology, and epidemiology. Am J Obstet Gynecol 1998; 179: S89-93. 11. Hsueh A.J.W., Welsh T.H., Jones P.B.C. Inhibition of ovarian progestin production by EGF in cultured rat granulosa cells. J Biol Chem 1982; 257: 11268-11273. 12. Knopp R.H., Zhu X.-D. et al. Sex hormones and lipid interactions: implications for cardiovascular disease in women. Endocrinology 1994; 4: 286-301. 13. Morales A.J., Laughlin G.A., Butzow T., Maheshwari H., Baumann G., Yen S.S. Insulin, somatotropic, and luteinizing hormone axes in lean and obese women with polycystic ovary syndrome: common and distinc features. J Clin Endocrinol Metab 1996; 81: 2854-2864. 14. Nestler J.E., Clore J.N., Blackard W.G. The central role of obesity (hyperinsulinemia) in the pathogenesis of the polycystic ovary syndrome. Am J Obstet Gynecol 1989; 161: 1095-1097. 15. Nestler J.E. Insulin regulation of human ovarian androgens. Hum Reprod 1997; 12: Suppl 1: 53-62. 16. Steinkampf M., Mendelson C., Simpson E.R. Effects of epidermal growth factor and insulin-like growth factor-I on the levels of mRNA encoding aromatase cytochrome P-450 of human ovarian granulosa cells. Mol Cell Endocrinol 1988; 59: 93-99. 17. Wild R A. Obesity, lipids, cardiovascular risk, and androgen excess. Am J Med 1995; 28: 29S |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||