Гиперпролактинемия: реакция костной ткани и эффективность терапии каберголином.
|
Проблема гиперпролактинемии (ГП) является предметом всестороннего исследования в течение последних 30 лет. Учитывая выраженное влияние данной патологии на репродуктивную систему, приоритетное значение придается изучению нарушений генеративной сферы. Однако последние годы растущий интерес представляет состояние общесоматичесого здоровья данных пациенток. К медицинским проблемам, зачастую сопровождающим ГП, относят остеопороз (ОП). По данным различных авторов, снижение минеральной плотности костной ткани (МПКТ) при гиперпролактинемии выявляется в 18-70% случаев [2, 30].
ОП - это системное заболевание скелета, характеризующееся снижением костной массы, микроархитектурными нарушениями костной ткани, приводящими к повышению ломкости костей и повышению риска переломов. Медленное развитие и бессимптомное течение процесса дали основание называть ОП "безмолвной эпидемией", что обуславливает необходимость ранней и точной диагностики процесса [2, 25]. В настоящее время для ранней диагностики ОП используются различные методы количественной костной денситометрии, применяются изотопные методы (моно- и двухфотонная абсорбциометрия), рентгеновские (моно- и двухэнергетическая абсорбциометрия, количественная компьютерная томография) и ультразвуковые [4, 7, 16]. Методы монофотонной, моноэнергетической и ультразвуковой денситометрии исследуют периферические отделы скелета и более подходят для постановки предварительного диагноза. В настоящее время методом выбора среди технологий измерения костной массы является двухэнергетическая рентгеновская абсорбциометрия (ДЭРА), обладающая неинвазивностью, низкой дозовой нагрузкой, высокой точностью и воспроизводимостью, позволяющая судить о гомеостазе, глубине, скорости и направленности патологического процесса, степени риска патологических переломов костей, объективно оценивающая эффективность лечения [3, 12, 14, 17, 33]. Развитие методов диагностики и появление возможности измерять костную массу количественно в разных отделах скелета позволили более четко разграничивать понятия "остеопения" и "ОП". Снижение МПКТ на 1-2,5 стандартных отклонения от нормативных показателей костной массы (SD) расценивается как остеопения (Т-критерий), снижение более чем на 2,5 стандартных отклонения - как ОП [10, 21]. Среди факторов риска ОП у женщин наиболее значимым считается дефицит половых стероидов (эстрогенов) [13, 17-19, 23]. По данным В. Biller, cнижение МПКТ у пациенток с гиперпролактиновым гипогонадизмом может достигать 3,8% в год [18]. Низкая пиковая костная масса и высокая скорость потери костного вещества в течение нескольких лет приводят к развитию ОП. У пациенток с ГП МПКТ в поясничном отделе на 25% ниже аналогичных показателей здоровых женщин группы контроля [29]. Отмечено, что показатели МПКТ по Z-критерию у молодых пациенток с ГП достоверно ниже, чем у пациенток в пери- и постменопаузе [24]. Учитывая, что потеря костной ткани происходит, как правило, постепенно и незаметно, а при гиперпролактинемическом гипогонадизме развивается в большинстве случаев уже в репродуктивном возрасте и зачастую диагносцируется после переломов, особенное внимание у пациенток с данным заболеванием должно уделяться ранней диагностике патологии костной системы. В связи с изложенным актуальным представляется определение факторов риска ОП и профилактика его возникновения. Целью данного исследования явилось определение МПКТ у пациенток с первичной ГП опухолевого и неопухолевого генеза и изучение влияния современного аналога дофамина каберголина на МПКТ у таких пациенток. Материал и методы Исследуемую группу составили 35 пациенток с ГП в возрасте 20-42 лет (средний возраст 31,7±6,17 лет), из них с опухолевым генезом 25, c неопухолевым - 10 пациенток. Уровень пролактина в 2 раза превышал верхнюю границу нормы при двукратном определении. Контрольную группу составили 15 здоровых женщин репродуктивного возраста. Критериями исключения явились: наличие синдрома поликистозных яичников, нарушение функции щитовидной железы или коры надпочечников, тяжелые острые или хронические общесоматические заболевания, терапия препаратами, влияющими на секрецию пролактина, терапия глюкокортикоидами и др. Проведены общеклинические исследования, УЗИ органов малого таза, гормональное обследование, ЭКГ, МРТ, Rt. Концентрации гормонов (ПРЛ, ЛГ, ФСГ, Е2, ТТГ, Т4, Т) определяли методом ИФА с помощью соответствующих тест-систем на автоматическом анализаторе Cobas Core II. МРТ обследование проводилось на оборудовании Magnetom Impact ("Siemens"). Исследование МПКТ в поясничных позвонках (L1, L2-L4) и проксимальных отделах бедренной кости (шейке бедра, треугольнике Варда, большом вертеле) методом ДЭРА проводилось на остеоденситометре Лунар исходно и через 12 мес. Фоновое состояние МПКТ оценивалось по Т-критерию (в величинах стандартного отклонения от значений пиковой костной массы женщин в возрасте 20-40 лет). Динамическая оценка МПКТ в процессе лечения представлена по Z-критерию. Cтатистическая обработка полученных данных осуществлялась с использованием статистической программы STATISTICA, для проверки гипотез на значимость использовались критерии Стьюдента, критерий знаков, на основе средней разности, Пирсона. Различия в полученных показателях считались достоверными при уровне надежности больше 95% (p меньше 0,05). Также для оценки качественных факторов использовались четырехклеточные таблицы сопряженности, для оценки меры взаимозависимости использовался коэффициент сопряженности Пирсона К, К1. Всем пациенткам с ГП назначался агонист дофамина каберголин в дозе от 0,5 до 2,0 мг в нед. Курс терапии составил 24 недели, длительность последующего наблюдения - 6 мес. Результаты Снижение МПКТ по данным ДЭРА было выявлено в 45,7% случаев, из них ОП в 14,3%, а остеопения в 31,4% случаев, в группе контроля МПКТ соответствовала возрастным нормативным значениям. Исследуемые группы были сопоставимы по возрасту, общеклиническим показателям, длительность ГП в среднем составила 6,14±0,83 лет, была несколько выше в опухолевой группе в сравнении с неопухолевой (табл. 1). Таблица 1. Клинико-анамнестические данные пациенток с ГП
В общеклинической картине гиперпролактиновых состояний преобладающими являлись нарушения функции яичников. У 33 (94,3%) из 35 пациенток были выявлены нарушения менструальной функции, у 27 (77,1%) пациенток - аменорея, у 6 (17,1%) - олигоменорея. В опухолевой группе нарушения менструального цикла наблюдались в 100% случаев: аменорея у 24 (96%) пациенток, олигоменорея у 1 (4%) пациентки. В группе с неопухолевым генезом ГП нарушения менструального цикла были отмечены в 80% случаев. Так, у 3 из 10 пациенток (30%) наблюдалась аменорея, у 5 (50%) - олигоменорея, регулярный менструальный цикл отмечен у 2 (20%) пациенток (табл. 2). Таблица 2. Характеристика менструальных циклов (м. ц.) у пациенток с ГП
Длительность аменореи в среднем составила 20,8±4,54 мес и в опухолевой группе оказалась значительно выше, чем в неопухолевой (25,3±5,9 и 9,7±4,8 мес соответственно, p меньше 0,05). Бесплодие было выявлено у 27 (77,1%) из 35 женщин, галакторея - у 30 (85,7%) из 35 пациенток. Исходный уровень пролактина в опухолевой группе (3511,5±364,5 мМЕ/л) был достоверно выше, чем в неопухолевой группе (1745±394,4 мМЕ/л, p меньше 0,05). Выявлено снижение уровней ЛГ и Е2, что косвенно свидетельствует о гипофункции яичников. В опухолевой группе средний уровень ЛГ был значительно ниже нормы (3,0±0,64 МЕ/л), в то время как в неопухолевой соответствовал норме (7,2±1,4 МЕ/л). Уровень Е2 в среднем составил 101,4±14,7 пмоль/л, в опухолевой группе - 84,6±12,6 пмоль/л, а в неопухолевой - 150,1±41 пмоль/л. Жалобы на боли в костях и суставах предъявляли 3 пациентки, у 3 пациенток в анамнезе отмечены переломы костей предплечья. Анализ данных ДЭРА показал, что частота снижения МПКТ выше в опухолевой группе в сравнении с неопухолевой. Сниженние МПКТ в опухолевой группе выявлено у 13 (52%) из 25 человек, в неопухолевой группе - у 3 (30%) из 10 пациенток. В опухолевой группе ОП выявлен у 5 (20%) пациенток, в то время как в неопухолевой группе не диагносцирован ни в одном случае. Результаты ДЭРА оценивались по всем исследуемым точкам, диагноз ОП ставился при наличии снижения по Т-критерию более 2,5 SD, остеопении - более 1 SD вне зависимости от обследованного участка. При оценке МПКТ с помощью Т-критерия, выявлено, что плотность кости у пациенток с ГП достоверно ниже, чем в группе контроля, а в опухолевой группе МПКТ значительно ниже, чем в неопухолевой (p меньше 0,05). Так, средний показатель Т-критерия в участке L1 у пациенток с ГП составил -0,5±0,2 SD, у женщин группы контроля - +0,5±0,2 SD (p меньше 0,05), у пациенток с опухолевыми формами ГП - -0,7±0,2 SD и у пациенток с неопухолевым генезом ГП - +0,2±0,4 SD (p меньше 0,05). Однако учитывая наличие в исследуемых группах пациенток как с ОП, так и с нормальными значениями МПКТ, были дополнительно проанализированы данные плотности костной ткани у пациенток со сниженной МПКТ (табл. 3). Таблица 3. Средние показатели МПКТ у пациенток с ОП и остеопенией (n=16)
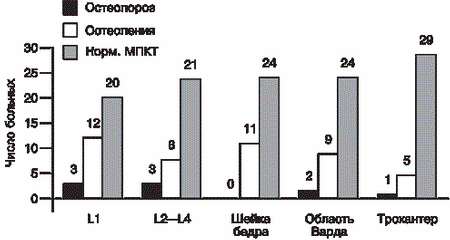
При исследовании исходного состояния костной массы в области поясничных позвонков (L1-L4) и в проксимальном отделе бедра было установлено, что степень снижения МПКТ в различных областях у одного и того же лица может быть разной. Так, частота ОП в поясничном отделе позвоночника приблизительно в 1,5 раза выше, чем в проксимальном отделе бедра. В то же время в некоторых случаях (11,4%) костные потери были более выражены в области Варда (область с преимущественно губчатой структурой кости). Так, по данным ДЭРА в поясничных позвонках снижение МПКТ отмечалось у 16 (45,7%) пациенток: ОП у 5 (14,3%) из 35 и остеопения у 11 (31,4%) из 35 пациенток. В проксимальном отделе бедра снижение костной массы выявлено у 11 (31,4%) из 35 пациенток: ОП у 3 (8,6%) и остеопения у 8 (22,9%) пациенток (рис. 1).
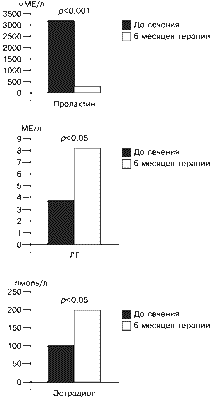
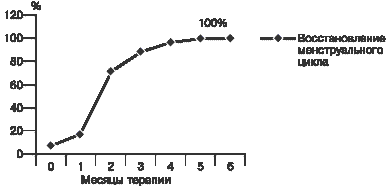
Анализ данных показал статистически достоверную корреляцию между МПКТ поясничных позвонков и проксимального отдела бедра (К1"0,83, p меньше 0,05). Во всех случаях остеопении в проксимальном отделе бедра выявлено выраженное снижение МПКТ в поясничном отделе позвоночника. В то же время у 5 (31,3%) пациенток со снижением МПКТ в поясничных позвонках показатели по бедру соответствовали норме. Полученные данные свидетельствуют о том, что наиболее выраженное снижение плотности костной ткани у пациенток с ГП происходит в поясничном отделе, в особенности в области L1. В проксимальном отделе бедра процесс деминерализации в большей степени наблюдается в области Варда и в шейке бедра в целом, наименее информативной оказалась область трохантера, хотя в одном случае именно по области трохантера был выявлен ОП. Полученные результаты свидетельствуют о большем снижении МПКТ в костях с преимущественным содержанием губчатого компонента у пациенток с ГП: поясничных позвонках и области Варда. В исследуемой группе была выявлена статистически значимая прямая зависимость между снижением МПКТ, длительностью аменореи и ОП (р меньше 0,05, К1"0,6). Аменорея более 12 мес отмечена у 11 (84,6%) из 13 пациенток с ОП. Высокая корреляция между длительностью аменореи и степенью разрежения костной ткани позволяет предположить существование очевидной взаимосвязи между характером нарушения гормонального баланса, наблюдаемого при аменорее, и вероятностью развития патологических процессов в костной ткани. Выявлена статистически значимая прямая зависимость между длительностью ГП (более или менее 5 лет) и снижением МПКТ (x2=6,48, K1=0,6, р меньше 0,05). У 91,4% пациенток со сниженной МПКТ длительность ГП составила более 5 лет. Обнаружена небольшая, но статистически достоверная корреляция между снижением МПКТ и исходным уровнем пролактина (x2=2,86 больше x2 кр, a=0,05), (группы были разделены по уровню пролактина более 2000 мМЕ/л и менее 2000 мМЕ/л). Интересно, что уровень пролактина был ниже 2000 мМЕ/л у 2 (12,5%) из 16 пациенток со сниженной МПКТ и у 8 (42,1%) из 19 пациенток с нормальной МПКТ. Так, средний уровень пролактина у пациенток с патологией костной ткани составил 3455±412,9 мМЕ/л, что практически совпадает со средними значениями гормона в опухолевой группе. Нормальные значения Е2 ( больше 150 пмоль/л) отмечены у 5 (20%) из 25 пациенток в опухолевой группе и у 4 (40%) из 10 в неопухолевой группе. Выявлено, что частота ОП и остеопении у пациенток с уровнем Е2 меньше 100 пмоль/л значительно выше, чем у пациенток с уровнем Е2 больше 100 пмоль/л (50 и 5,3% соответственно). Установлена тенденция к обратной зависимости при уровне надежности 90% (х2=1,86 меньше x2 кр). В исследуемой группе не выявлено зависимости ОП от возраста и индекса массы тела пациенток, а также курения. Курс терапии каберголином составил 6 мес. Уже после 2 мес лечения у большинства пациенток отмечалась нормализация уровня пролактина, а через 6 мес лечения средний уровень пролактина снизился до 306,6±54,6 мМЕ/л (р меньше 0,001), уровень ЛГ возрос до 8,3±0,7 мМЕ/л (р меньше 0,05), уровень Е2 повысился до 201,2±24,45 пмоль/л (р меньше 0,05) (рис. 2). После 4 мес терапии у 100% пациенток произошло восстановление регулярного менструального цикла (рис. 3).
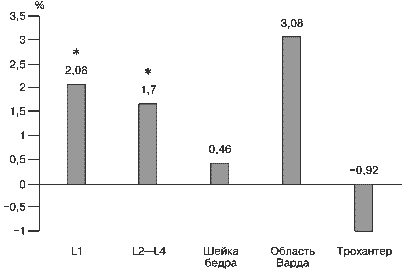
Оценка динамики показателей МПКТ на фоне терапии каберголином проводилась методом ДЭРА через 1 год от начала лечения. Полученные данные свидетельствуют о статистически достоверном повышении МПКТ в поясничном отделе позвоночника в среднем на 2%, для проксимального отдела бедра статистически значимой динамики не выявлено (рис. 4).
Обсуждение Снижение МПКТ у женщин, страдающих гиперпролактинемическим гипогонадизмом отмечено разными авторами [1, 8, 22, 24, 29]. Однако частота встречаемости ОП по данным литературы достаточно вариабельна (18-70%). Полученные нами данные свидетельствуют о снижении МПКТ у пациенток репродуктивного возраста с ГП в 45,7% случаев. Было также выявлено, что процесс деминерализации костной ткани более выражен в поясничном отделе позвоночника и в области Варда - в костях трабекулярного типа строения. Трабекулярные кости имеют структуру "пчелиных сот", обеспечивающую наибольшую площадь поверхности, наиболее высокий уровень обмена и наибольшую чувствительность к изменениям гомеостаза в организме. Метаболизм в трабекулярных костях протекает в 4-9 раз быстрее, чем в кортикальных костях, и здесь прежде всего можно обнаружить ОП [3]. Тот факт, что трабекулярный слой в сравнении с компактным, по мнению ряда авторов, подвержен большему влиянию половых стероидов, и объясняет, почему нарушения гормональной регуляции костного ремоделирования при ГП прежде всего отражаются на участках отдельных костей, наиболее богатых трабекулярным костным веществом [1]. При анализе частоты ОП при ГП опухолевого и неопухолевого генеза выявлена большая частота ОП у больных с пролактиномами гипофиза, что, по-видимому, связано с более выраженными изменениями в репродуктивной системе, большей частотой и длительностью аменореи у данных больных. Cуммируя представленные результаты корреляционной взаимосвязи гормональных и денситометрических исследований, можно отметить следующее: у больных с ГП нарушения в костной ткани достоверно коррелируют с уровнем пролактина и имеют тенденцию к корреляции с уровнем Е2 (наиболее часто снижение МПКТ при уровне пролактина более 2000 мМЕ/л и Е2 менее 150 пмоль/л). На основании полученных данных выявлена прямая корреляция снижения МПКТ с длительностью аменореи и ГП (p меньше 0,05). До настоящего времени механизм развития ОП при ГП представляется неоднозначным. Наряду с общепринятым положением о том, что ОП при ГП является вторичным и развивается в результате дефицита эстрогенов, обсуждается возможность непосредственного воздействия пролактина на процесс остеогенеза. Некоторыми авторами отмечено, что у пациенток с ГП и регулярным менструальным циклом снижения МПКТ не выявляется [23]. В то же время J. Schlechte и соавт. [30] не выявили значимой отрицательной динамики плотности поясничных позвонков в течение 5 лет наблюдения у пациенток с ГП и аменореей. Напротив, по данным других авторов, исследовавших 24 пациентки с пролактиномами, самые низкие значения костной массы были получены у больных с длительной аменореей (более 2 лет) [15]. Полученные нами данные о прямой корреляции ОП с длительностью аменореи вне зависимости от генеза ГП позволяют подтвердить предположение, что деминерализация кости у пациенток с ГП является следствием гипоэстрогении. Механизмы потери костной ткани при ГП до настоящего времени не уточнены. Ранее основным фактором в патогенезе ОП считался усиленный резорбтивный процесс в костной ткани [1]. По данным других исследователей, у пациенток с ГП и ОП отсутствуют изменения маркеров резорбции, при этом снижено костеобразование [5, 8, 10, 11]. По-видимому, вопросы патогенеза ОП при ГП будут изучены по мере накопления новых данных о маркерах костного ремоделирования, структуре и активности рецепторного аппарата пула костных клеток, местных факторах роста. Учитывая, что пациенты с ГП, особенно в сочетании с гипофункцией яичников, находятся в группе риска развития ОП, в этой группе женщин целесообразно проведение профилактического обследования с использованием современных методов исследования, в том числе ДЭРА [6]. Своевременное назначение терапии аналогами дофамина может остановить процесс костных потерь, а в некоторых случаях и повысить плотность костной ткани. При лечении вторичных ОП, каковым является ОП при ГП, ведущим направлением является коррекция основного заболевания. По данным некоторых авторов, на фоне терапии бромокриптином у пациенток с ГП отмечается остановка остеопоротического процесса, а в некоторых случаях и восполнение образовавшихся дефектов [22, 32]. Учитывая выраженное влияние на костную систему, некоторые авторы считают целесообразным профилактический прием аналогов дофамина пациенткам пременопаузального возраста и при незначительном повышении уровня пролактина [24]. В настоящее время в арсенале препаратов для лечения ГП появился новый высокоэффективный агонист дофамина III поколения - каберголин. Полученные нами данные о повышении МПКТ при лечении каберголином представляются обнадеживающими. При выраженном ОП возможно применение препаратов, направленных на активирование костеобразования, устранение повышенной резорбции и нормализацию обменных процессов в костной ткани. Должное внимание необходимо уделять симптоматическому лечению: диете, сбалансированной по содержанию кальция, фосфора и белка, препаратам солей кальция, ортопедическому лечению, лечебной физкультуре. Выводы
В.П. Сметник, А.А.Осипова Научный центр акушерства, гинекологии и перинатологии РАМН, Москва Литература 1. Байдак М.М. Акуш и гин 1995; 3: 35-37. 2. Беневоленская Л.И. Остеопороз и остеопатии. 1998; 1: 4-7. Болдырева Н.В. Гормонопрофилактика и терапия постменопаузального остеопороза. Дис. ... канд. мед. наук. М 1998. 3. Власова И.С. Остеопороз и остеопатии 1998; 2: 13-15. 4. Дедов И.И., Марова Е.И., Рожинская Л.Я. Остеопороз: патогенез, диагностика, принципы профилактики и лечения. М 1999. 5. Поворознюк В.В. Журн практического врача. 1996; 6: 18-20, 22. 6. Рахманов А.С., Бакулин А.В. Остеопороз и остеопатии. 1998; 1: 28-32. 7. Рожинская Л.Я., Марова Е.И. Дзеранова Л.К. и др. Пробл эндокринол М 1992; ноябрь-декабрь 38(6): 17-9. 8. Рожинская Л.Я. Ст-Петербургские врачебные ведомости 1994; 7: 17-23. 9. Рожинская Л.Я. М: КРОН-ПРЕСС, 1996; 208. 10. Рожинская Л.Я. Практическое руководство для врачей. М 2000. 11. Сметник В.П. Постменопаузальный остеопороз: принципы заместительной гормонотерапии. Остеопороз и остеопатии. 1998; 2: 21-24. 12. Сметник В.П., Кушлинский Н.Е., Болдырева Н.В. Остеопороз и остеопатии. 1999; 2: 16-19. 13. Харченко В.П., Рожкова Н.И., Зубовский Г.А. и др. Первый Российский симпозиум по остеопорозу. М 1995; 120-121. 14. Baldelli R., Perrone G., Nardone M.R., Galoppi P., Provenzano A., Fabbrini A., Rocco A. Minerva Endocrinol 1996; Mar 21(1): 7-11. 15. Baran D.T., Faulkner K.G., Genant H.K., Miller P.D., Pacifici R. Остеопороз и остеопатии. 1998; 3: 10-16. 16. Bellantoni M.F. Am Fam Physician 1996; Sept: 54(3): 986-92, 995-6. 17. Biller B., Baum H., Rosenthal D. et al. J Clin Endocrinol Metab 1992; 75: 698-703. 18. Christiansen C. Bone 1995; Nov 17: (5 Suppl): 513S-516S. 19. Сiccarelli E., Savino L., Carlevatto V. et al. Clin Endocrinol 1988; 28: 1: 1-6. 20. Faulkner K.G., Roberts L.A., McClung M.R. Osteoporos Int 1996; 6(6): 432-6. 21. Klibanski A., Greenspan S.L. N Engl J Med 1986; 315: 542-546. 22. Klibanski A., Biller B.M.K., Rosenthal D.I. et al. J Clin Endocrinol Metab 1988; 67: 124-130. 23. Koloszar S., Gelellen J., Kovacs L. Orv Fertil 1997; Jan 12: 138(2): 71-3. 24. Njeh C.F., Boivin C.M., Langton C.M. Osteoporos Int 1997; 7(1): 7-22. 25. Oursber M.J., Landers J.P., Riggs B.L., Spelberg N.C. Ann Med 1993; 25: 4: 361-371. 26. Ribot C., Tremollieres F. Ann Endocrinol Paris 1995; 56(1): 49-55. 27. Ross P.D. Osteoporosis. Arch Intern Med 1996; Jul 8: 156 (13): 1399-411. 28. Schlechte J., EI-Khoury G., Kathol M., Walkner L. J Clin Endocrinol Metab 1987; 64: 1021-1026. 29. Schlechte J., Dolan K., Sherman B. et al. J Clin Endocrinol Metab 1989; 68: 412-418. 30. Schlechte J., Walkner L., Kathol M. J Clin Endocrinol Metab 1992; 75: 698-703. 31. Torring O., Isberg B., Sjoberg H.E., Bucht E., Hulting A.L. Acta Endocrinol Copenh 1993; May: 128(5): 423-7. 32. Truscott J.G., Devlin J., Emery P. Baillieres Clin Rheumatol 1996; Nov 10(4): 679-98. 33. Wark J.D. Matiritas 1996; Mar 3(2): 193-207. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||