Особенности функции коры надпочечников у больных с хронической ановуляцией и гиперандрогенией
|
Повышение синтеза андрогенов является одной из наиболее частых причин ановуляции у женщин репродуктивного возраста [1]. Выявление источника гиперандрогении представляет значительные трудности. Это, по-видимому, связано филогенетической общностью яичников и коры надпочечников, аналогичным спектром синтезируемых андрогенов и сходством клинической картины при гиперандрогениях различного генеза [2, 3].
В последние годы предложены новые подходы, позволяющие определить источник гиперандрогении, что важно для назначения адекватной, патогенетически обоснованной терапии. Так, функциональная проба с использованием кортикотропина (АКТГ) позволяет выявить женщин-носительниц стертого дефекта ферментных систем коры надпочечников [4]. Однако диагностическая значимость этой пробы по-разному оценивается авторами [5-7]. Целью настоящей работы явилось изучение особенностей функции коры надпочечников у больных с хронической ановуляцией и гиперандрогенией в условиях стимуляции АКТГ. Материал и методы Обследованы 40 пациенток репродуктивного возраста с хронической ановуляцией и гиперандрогенией. Диагноз хронической ановуляции ставился при монофазной базальной температуре, концентрации прогестерона (П) в плазме крови в середине предполагаемой лютеиновой фазы цикла ниже 16 пмоль/л и/или при отсутствии секреторной трансформации эндометрия по данным биопсии. Гиперандрогения подтверждалась клинически (акне, гирсутизм) и лабораторно - повышение концентрации тестостерона (Т) и андростендиона (А) или дегидроэпиандростендиона сульфата (ДЭА-С) в плазме крови. В исследование не включали женщин с гиперпролактинемией, нарушением функции щитовидной железы, врожденной гиперплазией коры надпочечников (ВГКН), синдромом Кушинга. Пациентки не получали каких-либо гормональных препаратов на протяжении 3 мес до проведения исследования. Контрольную группу составили 10 женщин репродуктивного возраста с регулярным ритмом менструаций без клинических и лабораторных признаков гиперандрогении и других эндокринных нарушений. Овуляторный характер циклов подтверждался данными базальной температуры и концентрацией П в лютеиновую фазу цикла более 16 нмоль/л. Концентрацию гормонов в плазме крови определяли радиоиммунологическим методом с использованием наборов CIS bio international (Франция) и IMMUNOTECH (Чехия). За нормативные показатели приняты результаты, полученные в лаборатории эндокринологии Научного центра акушерства, гинекологии и перинатологии РАМН. Функциональная проба с АКТГ проводилась в модификации, предложенной лабораторией медицинской генетики центра с применением АКТГ 36-часового действия. В 9 ч утра производили взятие крови из локтевой вены, затем внутримышечно в плечо вводился препарат синактен-депо ("Сиба-Гейги", Швейцария) в количестве 1 мг/мл. Следующее взятие крови осуществлялось в 18 ч (на пике действия препарата) и в 9 ч следующего дня. Полученные данные обрабатывались с использованием дискриминантной функции (Д) по формуле, разработанной И.Г. Дзенис: Д = 0,052 [Х1] + 0,005 [Х2] - 0,018 [Х3], где Х1 - уровень 17-ОП через 9 ч после введения АКТГ; Х2 - отношение базального уровня кортизола (К) к базальному уровню 17-ОП; Х3 - отношение уровня К через 9 ч после введения АКТГ к соответствующему уровню 17-ОП. При Д больше 0,069 пациентка считалась носительницей гена недостаточности 21-гидроксилазы [4]. Взятие крови через 24 ч после введения синактена производилось для оценки функции коры надпочечников на фоне снижения активности препарата. Учитывая, что базальный уровень К в крови в норме колеблется в широком диапазоне, при оценке степени реакции данного гормона и андрогенов на стимуляцию использовались не абсолютные показатели, а прирост уровня гормонов в крови после введения АКТГ по сравнению с их исходной концентрацией [8]. Об активности ферментных систем надпочечников судили по следующим показателям: отношение DК/D17-ОП в качестве косвенной оценки активности фермента 21-гидроксилазы, отношению DА/D17-ОП, характеризующему в значительной степени активность фермента 17,20-лиазы [9]. Статистический анализ проводился с использованием прикладных программ итоговой описательной статистики и двухвыборочного t-теста для выборок с различными дисперсиями. Статистическая обработка результатов гормональных исследований проводилась по принципу лог-нормального распределения с вычислением среднего геометрического значения и его 95% доверительного интервала. Результаты Возраст пациенток основной (n=40) и контрольной (n=10) групп достоверно не различался и составил 25,7±0,7 и 26,7±0,9 года соответственно. Особенности менструального цикла женщин с хронической ановуляцией и гиперандрогенией заключались в нарушении менструального цикла по типу олигоменореи с менархе, несмотря на своевременное установление менструаций, что в целом характерно для пациенток с яичниковой гиперандрогенией [2, 10]. Все женщины контрольной группы имели регулярный менструальный цикл с менархе, средняя продолжительность цикла составила 28,0±0,4 дня. Табл.1 Гормональные параметры пациенток с бесплодием
Примечание. Приведены средние геометрические значения (границы 95% доверительного интервала). Звездочкой отмечена достоверность различий показателей p меньше 0,05. Исходные гормональные параметры у пациенток основной и контрольной групп приведены в таблице. Сравнительный анализ выявил достоверно более высокие величины уровня ЛГ и индекса ЛГ/ФСГ в группе женщин с хронической ановуляцией и гиперандрогенией. Уровень андрогенов в плазме крови у пациенток основной группы превышал нормативные показатели для женщин репродуктивного возраста и достоверно отличался от данных контрольной группы. Обращает на себя внимание тот факт, что у всех женщин основной группы уровень 17-ОП в плазме крови был в пределах нормы. Таким образом, ни одна из обследованных нами женщин с хронической ановуляцией и гиперандрогенией не имела клинически выраженной картины ВГКН. Показатели гормонального профиля у всех пациенток контрольной группы находились в пределах нормы. Введение препарата АКТГ вызывало значительное повышение уровня стероидов плазмы крови у пациенток основной и контрольной групп. После получения результатов изменения уровня К и 17-ОП для каждой пациентки производился подсчет дискриминантой функции - Д. Согласно полученным показателям Д, пациентки основной группы были разделены на две подгруппы: 1-я подгруппа - 4 женщины, являющиеся гетерозиготными носительницами гена 21-гидроксилазной недостаточности (Д больше 0,069), и 2-я подгруппа - 36 женщин, не являющихся носительницами (Д меньше 0,069). В контрольной группе ни одна из пациенток не являлась носительницей мутантного аллеля гена. Таким образом, носительство гена недостаточности 21-гидроксилазы выявлено у 4 (10%) из 40 женщин с хронической ановуляцией и гиперандрогенией. Результаты изменения уровня гормонов в плазме крови (% прироста их концентрации) на фоне стимуляции АКТГ приведены на рис. 1 и 2.
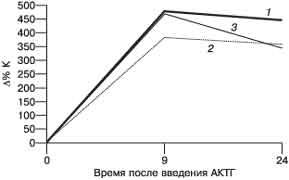
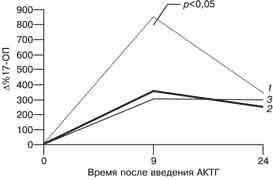
Рис.1 Реакция К (а) и 17-ОП (б) на введение АКТГ у пациенток с хронической ановуляцией и гиперандрогенией и у женщин без эндокринных нарушений. Здесь и на рисунке 2: 1 - основная группа (пациентки не являющиеся носителями); 2 - основная группа (пациентки-носительницы); 3 - контрольная группа
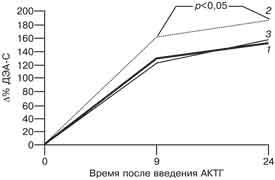
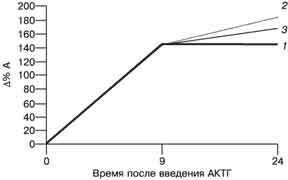
Рис. 2 Реакция ДЭА-С (а) и А (б) на введение АКТГ у пациенток с хронической ановуляцией и гиперандрогенией и у женщин без эндокринных нарушений. Как видно на рис. 1 и 2, введение АКТГ привело к 4-кратному повышению уровня К во всех группах женщин. При этом прирост уровня данного гормона через 9 ч после введения препарата у женщин-носительниц (383,6±74,2%) был значительно ниже, чем у женщин, не являющихся носительницами (479,8±67,4%), и у пациенток контрольной группы (470,7±46,8%), хотя эти различия и не достигают критериев достоверности при данном объеме выборки. Продукция К в группе женщин-носительниц сопровождалась накоплением предшественника его синтеза - 17-ОП. Прирост уровня 17-ОП через 9 ч в этой группе женщин составил 846,3±98,1%, что достоверно выше, чем в группе женщин с гиперандрогенией, не являющихся носителями (361,3±56,7%), и в контрольной группе (310,3±45,9%). Относительно низкий уровень К и достоверно более высокий уровень 17-ОП на пике стимуляции АКТГ у женщин-носительниц мутантного аллеля 21-гидроксилазы являются отражением ферментного блока в стероидогенезе коры надпочечников. У пациенток с хронической ановуляцией и гиперандрогенией обнаружено замедленное восстановление исходной концентрации К после введения АКТГ по сравнению с женщинами без эндокринных нарушений. Снижение уровня К через 24 ч по сравнению с пиковым составило 33,6±4,3% у пациенток, не являющихся носительницами, и 24,3±5,6% у пациенток-носительниц, что в 4-5 раз ниже, чем у женщин контрольной группы (122,9±10,6%). Уровень ДЭА-С и А через 24 ч превышал исходную величину и уровень через 9 ч во всех группах. Прирост уровня ДЭА-С у пациенток, не являющихся носительницами, составил 130,9±15,8% через 9 ч и 154,4±24,3% через 24 ч после введения препарата. Прирост уровня ДЭА-С в контрольной группе составил 124,4±16,9% на пике действия АКТГ и 157,8±23,6% через 24 ч от начала пробы. Обращает на себя внимание достоверно более высокий прирост уровня ДЭА-С в группе женщин-носительниц по сравнению с женщинами-неносительницами и пациентками контрольной группы. Прирост через 9 ч составил 163,9±25,7%, через 24 ч - 188,5±34,2%. Прирост уровня А через 9 и 24 ч после введения достоверно не отличался во всех трех группах женщин и составил соответственно 143,8±16,9 и 145,7±24,5% в подгруппе пациенток-неносительниц; 142,2±22,7 и 186,4±38,6% - в подгруппе пациенток-носительниц и 144±18,5 и 170,7±26,7% - в контрольной группе. Результаты определения относительной активности ферментов надпочечников представлены на рис. 3.
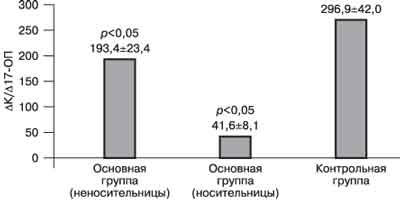
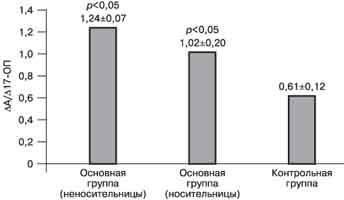
Рис. 3 Относительная активность ферментов 21-гидроксилазы (а) и 17,20 - лиазы (б) у пациенток с хронической ановуляцией и гиперандрогенией и у женщин без эндокринных нарушений. Относительная активность 21-гидроксилазы в группе женщин с регулярным циклом без эндокринных нарушений составила 296,9±42. Активность 21-гидроксилазы в подгруппе женщин с гиперандрогенией, являющихся носительницами, в 7 раз ниже, чем в контрольной группе - 41,6±8,1 (р меньше 0,05). Обращает на себя внимание, что и в подгруппе женщин с гиперандрогенией, не являющихся носительницами дефектного гена, активность 21-гидроксилазы достоверно ниже, чем в группе сравнения - 193,4±23,4. Относительная активность 17,20-лиазы, напротив, была достоверно выше в обеих подгруппах женщин с хронической ановуляцией и гиперандрогенией, чем в контрольной группе. Показатели активности 17,20-лиaзы составили в среднем 1,24±0,07 в подгруппе женщин, не являющихся носительницами, и 1,02±0,2 в подгруппе женщин-носительниц. В то же время относительная активность 17,20-лиазы в контрольной группе соответствовала 0,61±0,12 (р меньше 0,05). Обсуждение В многочисленных исследованиях показано, что функциональная яичниковая гиперандрогения в 50-60% случаев сопровождается повышенной секрецией андрогенов надпочечниками [2, 7, 13]. С другой стороны, хорошо известно, что поликистозные яичники (ПКЯ) развиваются вторично при повышении синтеза андрогенов надпочечниками вследствие ВГКН. Недостаточность 21-гидроксилазы - широкораспространенная аутосомно-рецессивная ферментопатия. Частота гетерозиготного носительства мутантных генов 21-гидроксилазы относительно высока и составляет - 1:100-1:1000, а в отдельных этнических популяциях (евреи, эскимосы) - 1:30 [14]. Для выявления данных состояний, когда исходные гормональные параметры не позволяют судить о возможном нарушении ферментных систем надпочечников, была предложена стимуляция надпочечников АКТГ. Анализ работ, посвященных применению теста с АКТГ, выявил большие различия в результатах исследований и их интерпретации. Всеми исследователями отмечается достоверно более высокий уровень 17-ОП и андрогенов надпочечников (ДЭА, А, ДЭА-С) у пациенток с хронической ановуляцией и гиперандрогенией в ответ на введение АКТГ по сравнению со здоровыми женщинами. Однако одни авторы полагают, что это можно трактовать как проявление стертых форм ВГКН или гетерозиготного носительства гена 21-гидроксилазной недостаточности [5, 6, 15]. В то же время другие исследователи считают, что гиперергическая реакция надпочечников пациенток с гиперандрогенией на АКТГ связана с дефектом другой ферментной системы - цитохрома Р450с17a [9, 16, 17, 19, 20]. S. Siegel при проведении теста с препаратом АКТГ короткого действия выявил у 61% пациенток с гирсутизмом мягкие дефекты в стероидогенезе надпочечников, показательные для стертой формы ВГКН [6]. Сходные данные получены W. Hague [13]. По данным Э.Р. Дуринян, проводившей пробу с АКТГ 36-часового действия, 67% пациенток с синдромом поликистозных яичников (СПКЯ) являются гетерозиготными носителями мутантного гена 21-гидpoкcилaзы [5]. Согласно результатам наших исследований, носительство гена недостаточности 21-гидроксилазы при расчете дискриминантной функции выявлено только у 10% женщин с хронической ановуляцией и гиперандрогенией. Эти различия в результатах, по-видимому, можно объяснить разными критериями, используемыми для формирования исследуемых групп больных. Однако мы не можем исключить влияния недостаточности 21-гидроксилазы на формирование симптомокомплекса хронической ановуляции и гиперандрогении у обследованных больных. Согласно полученным нами данным, даже в подгруппе женщин с гиперандрогенией, не являющихся носительницами дефектного гена, активность 21-гидроксилазы достоверно ниже, чем в контрольной группе. N. Rosenfield [14], D. Ehrmann [15] считают, что гиперергическую реакцию 17-ОП и андрогенов на введение АКТГ у женщин с гиперандрогенией нельзя трактовать как проявление недостаточности ферментных систем надпочечников. Они показали, что женщины с СПКЯ дают избыточное повышение уровня 17-ОП и А не только в ответ на АКТГ, но и при применении а-ГнРГ - нафарелина [16, 17]. Авторами было высказано предположение, что у пациенток с СПКЯ может наблюдаться дисрегуляция цитохрома Р450с17a - основного контролирующего фермента в биосинтезе андрогенов, который катализирует активность 17a-гидроксилазы и 17,20-лиазы. Так как экспрессия цитохрома Р450с17a обнаружена и в надпочечниках, и в яичниках [3, 18], то его внутренняя патология может объяснить как яичниковую, так и надпочечниковую гиперандрогению у пациенток с СПКЯ. Гипотезу о нарушении функции цитохрома Р450с17a у пациенток с СПКЯ поддерживают исследования F. Fruzzetti [17]. Согласно данным F. Gonzalez и соавт. [18], у 60% женщин имеется дисфункция цитохрома Р450с17a, которая характеризуется относительным снижением активности 17a-гидроксилазы и повышением активности 17,20-лиазы. В связи с этим интересно сообщение, что в геноме членов семей пациенток с СПКЯ выявляется дефект в промоутерном регионе гена CYP17, кодирующего синтез и функцию цитохрома Р450с17a [12]. В пользу этой гипотезы говорят и другие наблюдения. H. Escobar-Morreal и соавт. [9] продемонстрировали нормализацию ответа на АКТГ у пациенток с гиперандрогенией после супрессии яичников а-ГнРГ. I. Avivi [19] показал, что повторение теста с АКТГ после 6 мес применения препарата "Диане-35" выявило снижение стимулированного уровня 17-ОП ниже диагностического у 57% пациенток, которым прежде был поставлен диагноз стертой формы ВГКН. Типирование по системе HLA не выявило позитивного HLA-B14 у этих пациенток [21]. Так как было показано, что а-ГнРГ и ципротерона ацетат не способны прямо влиять на стероидогенез в надпочечниках, ряд авторов высказали предположение, что гиперчувствительность андрогенов надпочечников к АКТГ развивается вследствие относительной гиперэстрогении, характерной для хронической ановуляции [11, 12]. Согласно полученным нами данным, относительная активность фермента 17,20-лиазы достоверно выше у пациенток с хронической ановуляцией и гиперандрогенией по сравнению с женщинами без нарушений цикла и гиперандрогении. Обращает на себя внимание факт, что повышение активности данного фермента наблюдается в обеих подгруппах пациенток с гиперандрогенией, т.е. активность 17, 20-лиазы не связана с носительством гена недостаточности 21-гидроксилазы. Уровень андрогенов (ДЭА-С и А) через 24 ч превышал исходную величину и уровень через 9 ч во всех группах. Некоторыми авторами сохранение высоких концентраций стероидов надпочечников, несмотря на уменьшение силы действующего фактора (АКТГ), расценивалось как инертность процесса синтеза андрогенов у женщин с надпочечниковой гиперандрогенией [5, 22]. Однако расчет относительного прироста уровня андрогенов показал, что подобная картина характерна и для женщин без гормональных нарушений. Возможно это объясняется временными особенностями синтеза андрогенов. В исследованиях Э.Р. Дуринян [5] высказано предположение, что у части больных с СПКЯ наблюдается гиперфункция коры надпочечников, которая проявляется замедленным снижением уровня К после прохождения пика действия АКТГ. Сходные данные получены и в нашем исследовании. У пациенток с хронической ановуляцией и гиперандрогенией вне зависимости от носительства гена 21-гидроксилазной недостаточности обнаружено замедленное восстановление исходной концентрации К после введения АКТГ по сравнению с женщинами без эндокринных нарушений. Возможно, что повышенная чувствительность надпочечников к стимулирующему воздействию АКТГ и более длительный период восстановления нормальной их функции могут служить причиной нарушения менструальной функции при различных стрессовых ситуациях, что наблюдалось у некоторых пациенток с гиперандрогенией. Заключение Результаты данной работы, а также многочисленные исследования других авторов свидетельствуют, что значительная группа пациенток с хронической ановуляцией и гиперандрогенией имеют мягкие дефекты стероидогенеза и функциональную гиперактивность коры надпочечников. Вероятно, с этим связан благоприятный эффект глюкокортикоидной терапии у части женщин с яичниковой гиперандрогенией. Лечебное воздействие дексаметазона в данном случае не столько носит заместительный характер, сколько способствует устранению избыточной реакции на воздействие стимулирующих факторов, а следовательно, оптимизации функции гипоталамо-гипофизарно-надпочечниковой системы. Т.В. Овсянникова, Н.Д. Фанченко, Н.В. Сперанская, О.И. Глазкова Научный центр акушерства, гинекологии и перинатологии РАМН; Московская медицинская академия им. И.М. Сеченова Минздрава РФ, кафедра акушерства и гинекологии ФППО, Москва Литература 1. Chronic anovulation. Technical Bulletin ACOG n 202. 1995; 2:1-7. 2. Гаспаров A.C. Клиника, диагностика и отдаленные результаты лечения бесплодия у пациенток с ПКЯ: Дис. ... д-ра мед. наук. М 1996; 274. 3. Гончаров Н.П. Андрогены. Пробл эндокринол 1996; 42: 4: 28-31. 4. Дзенис И.Г. Современные пути диагностики и профилактики наследственной недостаточности 21-гидроксилазы: Дис. ... д-ра мед. наук. М 1995. 5. Дуринян Э.Р. Клинико-патогенетическое обоснование дифференцированного подхода к лечению пациенток с СПКЯ. Дис. ... канд. мед. наук. М 1997; 169. 6. Siegel S. ACTG stimulation test in Women with Girsutism. New Engl Med J 1990; 232: 13: 849-854. 7. Speroff L., Gtass R.H., Kase N.G. Clinical Gynecological Endocrinology and Infertility 5-th Congr. Td. Williams & Wilkins. 1994. 8. Комаров E.K. Особенности функции коры надпочечников у больных с гиперандрогенией различного генеза. Акуш и гин 1991; 12: 41-44. 9.Escobar-Morreale Н. et al. Adrenal androgens in ovarian hirsutism. Fertil Steril 1997; 67: 4: 654-662. 10. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология, 2-е изд. Ст-Петербург 1995. 11. Flamigni С. Defining PCOS. In "The Ovary: regulation, dysfunction and treatment" ed. by Filicori М. and Flamigni C. Elsevier Science B.V. 1996; 337-350. 12. New М. Nonclassical 21-hydroxylase deficiency. In: "Polycystic Ovary Syndrom", ed. by Dunaif A., Givens J et al. Mosby-Year Book 1992; 145-162. 13. Hague W.M. Steroid responses to ACTH in PCO. Clin Endocrinol 1989; 30: 355-365. 14. Rosenfield Rl., Barnes R.B., Cara J.F. et al. Dysregulation of cytochrome P450c17a as a cause of PCOS. Fertil Steril 1990; 53: 785-791. 15. Ehrmann D. Detection of functional ovarian hyperandrogenism in women with androgen excess. New Engl J Med 1991; 327: 3: 157-162. 16. Franks S. Polycystic Ovary Syndrome. New Engl J Med 1995; 33: 13: 853-861. 17. Fruzzetti F. et al. Adrenal androgen secretion in PCOS. Fertil Steril 1995; 63: 4: 734-741. 18. Gonzalez F. et al. Heterogeneous adrenal dysfunction in PCOS. Fertil Steril 1996; 66: 3: 354-361. 19. Avivi I. Overdiagnosis of 21-hydroxylase late onset САН. Fertil Steril 1996; 66: 4: 557-562. 20. Аймалазян Э.К., Устинкина Т.И. Эпидемиология бесплодия в семье. Акуш и гин 1990; 9: 46-49. 21. Azziz R., Bradley E.L., Potter H.D. et at. 3b-hydroxysteroid dehydrogenase deficiency in hyperandrodenism. Am J Obstet Gynecol 1993; 168: 889-895. 22. Carey A.N., Waterworth D., Patek K. et al. Evidence for single gene defect in PCO and mate pattern baldness. Clin Endocrinol 1993; 38: 653-8. |