Коррекция инсулинорезистентности у женьщин в постменопаузе.
|
Современная женщина около трети своей жизни проводит в состоянии постменопаузы и именно для этой возрастной категории отмечается достаточно высокая распространенность сахарного диабета II типа (СД II) и ожирения, что может быть объединено таким понятием, как «менопаузальный метаболический синдром».
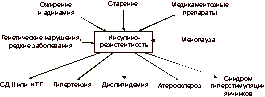
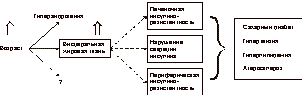
Последний включает в себя физиологическое снижение уровня эстрогенов, нарушения углеводного обмена, артериальную гипертензию, нарушения гемостаза, ожирение, остеопороз или остеопению. Кроме того, снижение уровня эстрогенов в менопаузе связано с увеличением числа факторов риска атерогенеза, что ведет к развитию ишемической болезни сердца (ИБС), артериальной гипертонии, атеросклероза и инсультов (рис. 1, 2). Физиологическое старение является инсулинорезистентным состоянием [1]. Инсулинорезистентность ассоциируется с типичными изменениями количественного состава тела, а также с наличием других сопутствующих заболеваний [6, 17]. С возрастом происходят изменения углеводного обмена, выражающиеся в нарушении секреции инсулина b-клетками поджелудочной железы и снижении периферической чувствительности к нему (инсулинорезистентность). Частота встречаемости СД II у женщин в возрасте 60-70 лет составляет » 10-20% в сравнении с 3-5% в возрасте 40-50 лет. Однако 80-летний возрастной рубеж увеличивает количество заболевших СД II женщин в среднем еще на 17% [6, 23]. Кроме того, внедрение в клиническую практику новых критериев диагностики СД еще больше увеличивает количество больных женщин. В последние годы значительное внимание уделяется нарушениям липидного обмена у женщин в постменопаузе [2, 19-21]. Избыточная масса тела в сочетании с физиологическим снижением гормональной функции яичников у женщин старше 55 лет считается независимым фактором риска развития атеросклероза, ИБС, гипертензии и гиперлипидемии. Целью исследования явился сравнительный анализ применения антигипергликемических и эстроген-гестагенных препаратов для заместительной гормональной терапии (ЗГТ), а также их комбинации у женщин в постменопаузе, оценка их влияния на показатели углеводного и липидного обмена и на композиционный состав тела. Материал и методы В клинике ЭНЦ РАМН обследованы 56 женщин в постменопаузе (возраст 55-65 лет). При проведении всем обследуемым перорального глюкозотолерантного теста (ПГТТ) у 30 (53,6%) из них впервые выявлены следующие нарушения углеводного обмена: СД II у 17 (57%) женщин; нарушение толерантности к глюкозе (НТГ) - у 13 (43%). У оставшихся 26 женщин выявлена базальная гиперинсулинемия, подтвержденная повышенным уровнем иммунореактивного инсулина в сыворотке крови на фоне еизмененных показателей ПГТТ. Диагноз СД II ставили на основании классификации и диагностических критериев ВОЗ. У 7 (41,1%) женщин выявлялись осложнения СД в виде микро- и макроангиопатий, нейропатии в начальной стадии развития.
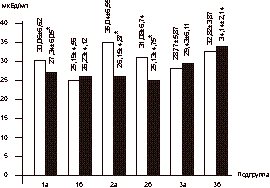
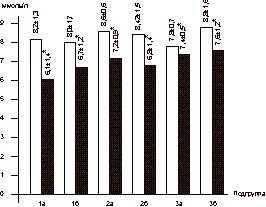
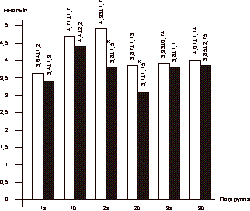
Женщины были разделены на 3 группы в зависимости от вида назначаемой терапии, а каждая группа рандомизирована на 2 подгруппы в зависимости от показателя индекса массы тела (ИМТ). В 1-ю группу вошли 18 женщин в возрасте 56-60 лет (средний возраст 58,2±1,8 года). Подгруппу 1а составили 10 женщин с ИМТ і30 (масса тела 79,2±8,7 кг): у 4 женщин был диагностирован СД II, у 3 пациенток - НТГ. Подгруппу 1б составили 8 женщин с нормальной массой тела (58,4±4,8 кг; ИМТ 27,8±1,1). У 1 женщины был выявлен СД II, у 2 пациенток - НТГ. В данной группе проводилось комбинированное лечение антигипергликемическим препаратом сиофор в дозе 1000 мг/сут в сочетании с ЗГТ эстроген-гестагенными препаратами (фемостон). Во 2-ю группу вошли 20 женщин в возрасте 58-63 лет (средний возраст 59,2±2,4 года). Подгруппу 2а составили 10 женщин, имеющих избыточную массу тела (85,4±3,7 кг; ИМТі30). У 6 пациенток выявлялся СД II в состоянии субкомпенсации; у 3 женщин - НТГ. Подгруппу 2б составили 10 женщин с массой тела 56,2±3,3 кг, ИМТ 25,9±2,2. У 2 пациенток был выявлен СД II; у 1 женщины - НТГ. Все женщины данной группы принимали сиофор (1000 мг/cут). В 3-ю группу вошли 18 женщин в возрасте 56-62 лет (средний возраст 58,7±2,5 года). Подгруппу 3асоставили 12 женщин: у 3 женщин выявлен СД II, у 2 - НТГ, ИМТ в данной подгруппе составил 33,04±5,68, а масса тела 82,1±2,6 кг. Подгруппу 3б составили 6 пациенток с массой тела 67,2±3,8 кг (ИМТ 28,1±1,1). СД II был диагностирован у 1 пациентки; НТГ - у 2. В данной группе лечение проводилось с использованием только ЗГТ эстроген-гестагенными препаратами (фемостон). Критерии включения: - женщины в фазе постменопаузы в возрасте 55- 65 лет; - отсутствие менструаций не менее 2 лет; - толщина эндометрия (М-эхо) по данным УЗИ органов малого таза не более 4 мм; - женщины с выявленной базальной гиперинсу- линемией с нормальной и избыточной массой тела; - СД II в состоянии компенсации или субком- пенсации с минимальной выраженностью сосу- дистых осложнений; - НТГ; - согласие больной на участие в исследовании. Критерии исключения: - СД II в состоянии декомпенсации, кетоацидоз; - наличие в анамнезе инфаркта миокарда и ост- рой тромбоэмболии в течение года до начала исследования; - повышенный уровень креатинина и мочевины в крови; - узловая форма фиброзно-кистозной мастопатии; - наличие каких-либо онкологических заболева- ний; - отказ женщины от участия в исследовании. В качестве лекарственного средства, влияющего на углеводный обмен, использовали препарат из группы бигуанидов - метформин (сиофор, "Берлин-Хеми", Германия) в дозе 1000 мг/сут (500 мг, 2 раза в день). ЗГТ проводилась препаратом фемостон (микронизированный 17-b-эстрадиол 2 мг + дидрогестерон 10 мг, «Солвей Фарма», Голландия). Уровень гликированного гемоглобина (HbA1c) определялся с помощью жидкостной хроматографии под давлением (нормальный уровень 4,5-6,2%). У всех больных определяли общий холестерин, фракции липопротеидов низкой и высокой плотности, триглицериды; уровень секс-связывающего глобулина (ССГ) в сыворотке крови. Содержание иммунореактивного инсулина (ИРИ) и С-пептида определяли методом ИРМА с использованием наборов Иммунотекс (Франция, Чехия). Для оценки степени резистентности к инсулину использовалась малая модель гомеостаза (Homeostasis Model Assessment-HOMA) c определением показателя HOMA-R, косвенно отражающего степень чувствительности к инсулину и вычисляемого по формуле: HOMA-R = уровень гликемии натощак (УГН) [ммоль/л] Ѕ уровень инсулина натощак (УИН) [мЕД/мл]/ 22,5. Также определяли уровни ЛГ, ФСГ, ТТГ, ДЭА-С, Т и Е2, ультразвуковое исследование органов малого таза, печени и надпочечников. Композиционный состав тела изучали с помощью двуэнергетической рентгеновской абсорбциометрии с использованием специального пакета программ на аппарате Эксперт XL фирмы «Лунар» (США). Сравнение полученных данных проводилось исходно и через 6 мес на фоне лечения. Статистическая обработка данных осуществлялась с использованием вариационных статистических программ Microsoft Excel. Результаты Динамика уровня гликемии натощак и содержания ИРИ в сыворотке крови у обследуемых больных представлена на рис. 3 и 4. При анализе данных выявлена прямая корреляционная связь между уровнем гликемии натощак и содержанием ИРИ: чем меньше уровень базальной гликемии, тем меньше уровень ИРИ. Однако данная зависимость выявлялась только в подгруппах женщин с избыточной массой тела (1а: r=0,438, p<0,05; 2а:r =0,413; p<0,05, 3а: r=0,450, p<0,05). Достоверное снижение уровня гликемии натощак и базального ИРИ в ходе лечения отмечено в группах 1 и 2 и не зависело от показателя ИМТ. В подгруппах 1а и 1б снижение базальной гликемии составило в среднем 22 и 9,7% соответственно (1а: 6,14±0,95 ммоль/л; 1б: 6,95±1,42 ммоль/л через 6 мес, p<0,05). Снижение уровня ИРИ в подгруппе 1а составило 9% (30,06±6,62 мЕД/мл исходно, через 6 мес - 27,34±6,05 мЕД/мл, p<0,05). В подгруппе 1б (женщины с нормальной массой тела, находящиеся на комбинированной терапии сиофором и фемостоном) уровень ИРИ не изменился (25,19±4,56 мЕД/мл исходно; 26,23±4,12 мЕд/мл через 6 мес). В подгруппе 2а (женщины с избыточной массой тела, получавшие терапию сиофором) уровень гликемии снизился с 8,59±1,24 до 5,99±1,95 ммоль/л, что составило 30% (p<0,05), уровень ИРИ - с 35,04±6,55 до 26,15±4,87 мЕД/мл через 6 мес терапии (p<0,05).
Здесь и на рис.4—7: I — исходный уровень; II — через 6 мес лечения; * — р<0,05. В подгруппе 2б (пациентки с нормальной массой тела) гликемия до начала терапии составила 8,64±1,98 ммоль/л; через 6 мес - 6,44±0,26 ммоль/л (p<0,05), уровень ИРИ исходно - 31,08±6,74 мЕД/мл, через 6 мес лечения - 25,13±4,75 мЕД/мл (p<0,05). Однако в группе женщин, принимавших ЗГТ (подгруппы 3а и 3б), не выявлено достоверного снижения вышеназванных показателей. Данные ИМТ, отношения ОТ/ОБ (объем талии/объем бедер) исходно и на фоне проводимой терапии в исследуемых группах больных представлены в табл. 1. Как видно из табл. 1, в группе женщин, принимавших сиофор в сочетании с ЗГТ и имевших избыточную массу тела (подгруппа 1а), достоверно снизились (в среднем на 6%) показатели ИМТ (до начала лечения 32,16±3,68, через 6 мес терапии - 29,50±3,04; p<0,05). В подгруппе женщин с нормальной массой тела (1б) не обнаружено изменений в показателях ИМТ. Однако выявлены статистически достоверные изменения в показателе ОТ/ОБ в подгруппе женщин с избыточной массой тела, находящихся на терапии сиофором (исходно - 0,98±0,12; через 6 мес терапии - 0,79±0,13; p<0,05) при норме ОТ/ОБ для женщин в постменопаузе <0,88. Величина ОТ/ОБ >0,88 у женщин свидетельствует о висцеральном ожирении, что часто связано с развитием инсулинорезистентности. Во 2-й группе женщин, принимавших только метформин (подгруппа 2а), выявлено снижение (в среднем на 7%) показателя ИМТ (исходно - 33,27±1,13, через 6 мес лечения - 30,85±0,9, p<0,05), а коэффициент ОТ/ОБ изменился с 0,90±0,01 до 0,77±0,01 через 6 мес терапии (p<0,05). В подгруппе женщин с нормальной массой тела (2б) уменьшение показателя ОТ/ОБ верифицировалось на фоне статистически неизмененных величин ИМТ. Таблица 1. Динамика показателей ИМТ, ОТ/ОБ на фоне терапии (n=56)
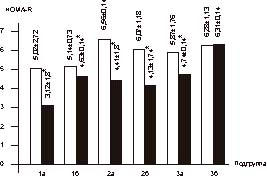
p<0,05. В группе женщин, принимавших только ЗГТ (3-я группа), не обнаружено статистических различий в показателях ИМТ. Однако в подгруппе женщин с избыточной массой тела коэффициент ОТ/ОБ снизился с 0,92±0,14 до 0,83±0,03 через 6 мес лечения (p<0,05). Оценка динамики показателей (HbA1c) (норма до 6,2%) на фоне терапии представлена в табл. 2. В подгруппе женщин с избыточной массой тела (1а), находившихся на терапии сиофором в сочетании с ЗГТ, снижение уровня HbA1c через 6 мес лечения составило в среднем 19%, в подгруппе женщин с нормальной масcой тела (1б) - 10%. В подгруппе 2а (сиофор, 1000 мг/сут) снижение уровня HbA1с было максимальным (в среднем 27%), в подгруппе 2б (ИМТЈ29) оно составило 18%. В 3-й группе женщин, принимавших ЗГТ, изменения уровня HbA1с не отмечено ни в одной из подгрупп. С целью оценки степени резистентности к инсулину в ходе исследования мы изучали показатель HOMA-R во всех обследуемых группах (рис. 5). В подгруппах 1а и 2а отмечено достоверное снижение показателя HOMA-R, составившее в среднем 37,6 и 32,8% соответственно (1а: исходно - 5,02±2,72, через 6 мес лечения - 3,12±1,8; p<0,05; 2а: исходно - 6,56±0,14; через 6 мес лечения - 4,41±1,8; p<0,05). В подгруппах 1б и 2б (женщины с нормальной массой тела) также отмечено снижение (в среднем 10 и 32% соответственно) показателя HOMA-R (1б: исходно - 5,14±0,73, через 6 мес терапии - 4,63±0,14; p<0,05; 2б: исходно - 6,07±1,18, через 6 мес лечения - 4,13±1,74; p<0,05). В 3-й группе женщин с нормальной массой тела (3б) изменения показателя HOMA-R были статистически недостоверными. Однако в подгруппе 3а (женщины с избыточной массой тела) отмечено достоверное его снижение (в среднем 12%; с 5,87±1,76 до 4,74±0,14; p<0,05). В ходе исследования у всех женщин проводился сравнительный анализ композиционного состава тела (табл. 3). До начала терапии во всех подгруппах женщин с нормальной массой тела (1б, 2б, 3б) отмечено преобладание мышечной ткани над жировой.
В группе женщин, получавших антигипергликемическую терапию в течение 6 мес (2-я группа), снижение количества жировой ткани выявлялось в обеих подгруппах пациенток (в среднем 26,3 и 7% соответственно). Причем в подгруппе женщин с избыточной массой тела (2а) также отмечалось снижение мышечной массы (исходно - 43,873±4,188 г; через 6 мес терапии - 40,398±4,005 г; p<0,05). В группе женщин, находящихся на ЗГТ, статистически достоверное уменьшение (в среднем 7%) жировой ткани отмечено лишь в подгруппе пациенток с избыточной массой тела (3а). Таблица 2. Динамика показателей HbA1c (%) на фоне терапии (n=56)
* p<0,05 (сравнение исходных показателей с показателями через 6 мес лечения). Таблица 3.Анализ композиционного состава тела обследованных женщин (по данным рентгеновского абсорбциометрического исследования; n=56)
* p<0,05 (сравнение исходных показателей с показателями через 6 мес лечения). При анализе данных, полученных при обследовании женщин 1-й группы (ЗГТ+сиофор), выявлено достоверное снижение (в среднем 9,8%) количества жировой ткани только в подгруппе пациенток с ИМТі30 (подгруппа 1а). Однако снижение мышечной массы выявлено в обеих подгруппах (8 и 4,8% соответственно). Анализ показателей минеральной плотности костной ткани (МПКТ), оцениваемый исходно и определяемый по Т- и Z-критериям, выявил ее снижение во всех группах обследованных женщин. Однако в подгруппах женщин с избыточной массой тела (1a, 2а, 3а) показатели МПКТ (T- и Z-критерий) статистически превышали показатели, полученные в подгруппах женщин с нормальной массой тела, что, по-видимому, связано с периферической конверсией эстрона из андростендиона и эстрадиола из тестостерона в жировой ткани у тучных женщин, а также с повышенной пролиферацией остеобластов под действием гиперинсулинемии у данной категории больных (табл. 4). В табл. 5 представлена сравнительная оценка показателей (Т, ССГ, Е2) в обследованных группах женщин. Анализ полученных результатов показал (см. табл. 5), что во всех группах обследуемых женщин исходный уровень свободного Т превышал верхнюю границу возрастной нормы (кроме подгруппы 1б) на фоне низких показателей ССГ и Е2. При этом в подгруппах женщин с нормальной массой тела (1б, 2б, 3б) уровень Е2 соответствовал нижней границе возрастной нормы (54,3±1,12, 64,25±8,12, 53,25±1,2 нмоль/л соответственно; p<0,05). Таблица 4. Анализ показателей МПКТ по T- и Z-критериям
p<0,05 (сравнение показателей в подгруппах женщин с нормальной и избыточной массой тела). Таблица 5. Сравнительная оценка уровня Т, ССГ, Е2 (в нмоль/л) в обследованных группах женщин на фоне терапии
p<0,05 (сравнение показателей исходно и через 6 мес лечения). В 1-й группе женщин, находившихся на терапии сеофором в сочетании с ЗГТ, отмечено максимальное снижение урoвня Т (в среднем на 31%), повышение уровня ССГ (на 87%), уровня Е2 (на 49,2%) в ходе лечения в сравнении с другими группами. Также необходимо отметить, что в группе женщин, принимавших только антигипергликемическую терапию (2-я группа), снижение уровня свободного Т составило в среднем 7,1%, а изменения показателя Е2 носили отрицательную динамику (1a: исходно - 98,56±4,3 нмоль/л, через 6 мес лечения - 80,1±2,0 нмоль/л; p<0,05; 2б: исходно - 64,25±8,12 нмоль/л, через 6 мес лечения - <50 нмоль/л; p<0,05). В группе женщин, находившихся на ЗГТ эстроген-гестагенным препаратом (фемостон) (3-я группа), отмечено достоверное снижение уровня Т (на 5,2%), повышение уровня ССГ (на 75,46%) и максимальное повышение уровня Е2 (на 139,6% в подгруппе 3а и на 419,5% в подгруппе 3б). В ходе исследования во всех группах женщин выявлена прямая корреляционная зависимость между уровнем свободного Т в сыворотке крови и показателем HOMA-R: чем выше уровень Т, тем выше показатель HOMA-R (группа 1: r=0,438, p<0,05; группа 2: r=0,375, p<0,05; группа 3: r=0,524, p<0,05). Между уровнем Т и уровнем ССГ выявлена обратная корреляционная зависимость: чем выше уровень Т, тем ниже уровень ССГ (группа 1: r= -0,386, p<0,05; группа II - r= -0,526, p<0,05; группа 3: r= -0,482, p<0,05). Сравнительный анализ показателей липидного обмена выявил следующее: максимальная динамика уровня общего холестерина в сыворотке крови отмечалась в подгруппах женщин (как с избыточной, так и с нормальной массой тела), находившихся на комбинированной терапии сиофором+ЗГТ (для подгруппы 1a - 32%, подгруппы 1б - 27%; p<0,05). Кроме того, статистически достоверное снижение уровня общего холестерина отмечено во всех обследуемых группах. Однако в группе женщин, находившихся лишь на ЗГТ, максимальная (в среднем 12%) динамика отмечалась в подгруппе пациенток с нормальной массой тела (подгруппа 3б) (рис. 6). Повышение уровня фракции ЛПВП отмечено только в 1-й группе женщин (1а: исходно - 1,32±0,28 ммоль/л, через 6 мес лечения - 1,74±0,18 ммоль/л, p<0,05, 1б: исходно - 1,18±0,14 ммоль/л). Во 2-й группе женщин уровень ЛПВП статистически изменился лишь в подгруппе женщин с нормальной массой тела (2б: исходно - 1,54±0,26 ммоль/л; через 6 мес лечения - 1,86±0,24 ммоль/л; p<0,05). В группе женщин, получавших ЗГТ (3-я группа), также отмечено статистически достоверное повышение уровня ЛПВП, но лишь в подгруппе пациенток с ИМТЈ29 (3б: исходно - 1,23±0,84 ммоль/л; через 6 мес лечения - 1,41±0,76 ммоль/л; p<0,05). Динамика уровня фракций ЛПНП в ходе лечения выявила его статистически достоверное уменьшение лишь в группе женщин, находившихся на антигипергликемической терапии (подгруппа 2а: исходно - 4,93±1,7 ммоль/л; через 6 мес лечения - 3,8±1,5 ммоль/л, что составило 77%; p<0,05; 2б: исходно - 3,87±1,13 ммоль/л; через 6 мес лечения - 3,1±1,15 ммоль/л, что составило 80%; p<0,05) (рис. 7). Достоверное снижение уровня триглицеридов отмечено во всех обследованных группах женщин и составило в среднем в подгруппах 1а - 62,1%; 1б - 59,2%; 2а - 75,8%; 2б -70,9%; 3а - 43,7%; 3б - 80% (p<0,05). Обсуждение результатов Одним из решений проблемы увеличения средней продолжительности жизни женщины явилось применение ЗГТ. Использование для ЗГТ половых стероидов с правильно подобранным прогестагеновым компонентом (норэтистерона ацетат - при краткосрочных режимах; дидрогестерон - при долгосрочных) не ухудшает состояние углеводного обмена, улучшает показатели липидного спектра и используется у женщин с СД II с лечебной и профилактической целями [2]. Однако данная терапия не решает проблему "возрастной инсулинорезистентности" и, естественно, не влияет на многие звенья в патогенезе физиологического старения.
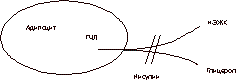
Инсулинорезистентность является метаболическим нарушением (как первичным, так и вторичным), приводящим к развитию CД II, ожирения, дислипидемии, гипертензии и соответственно раннему возникновению сердечно-сосудистых заболеваний [8, 9, 17, 18]. К инсулинорезистентности могут приводить избыточная масса тела, гиподинамия, менопауза, медикаментозные препараты, а также генетические нарушения (см. рис. 1). С возрастом происходят изменения углеводного обмена, проявляющиеся в нарушении секреции инсулина b-клетками поджелудочной железы и снижением периферической чувствительности к нему (инсулинорезистентность) [3-5]. Это обусловлено тем, что у людей старшей возрастной группы для поддержания уровня гликемии необходима определенная гиперинсулинемия, выявленная в виде базальной гиперинсулинемии в ходе нашего исследования во всех группах обследованных женщин. Примечательно, что базальная гиперинсулинемия выявлялась в подгруппах женщин как с избыточной, так и с нормальной массой тела. Общеизвестно, что уровень глюкозы в крови регулируется взаимодействием на уровне мышечной ткани (снижение уровня постпрандиальной гликемии), печени (поддержание уровня глюкозы натощак) и b-клеткой поджелудочной железы (секреция необходимого количества инсулина). С биохимической точки зрения, инсулин активирует фосфорилирование рецепторов наряду с фосфорилированием производных тирозина - множественных инсулинорецепторных субстратов (например, IRS-1, IRS-2) и многие изоформы фосфатидилинозито-3(PI-3) киназы. Снижение чувствительности рецепторов b-клеток ухудшает глюкозостимулированную секрецию инсулина (но не L-аргининстимулированную секрецию инсулина) и приводит к нарушениям глюкозотолерантности и развитию СД II или НТГ [12-14]. Кроме того, в норме печень способствует поддержанию физиологического уровня глюкозы в крови. При физиологическом старении требуется больше инсулина для регуляции продукции глюкозы печенью, а его секреция b-клетками компенсирует резистентность к его действию на уровне мышц и печени [14, 15]. Инсулинорезистентность можно определить как патофизиологическое состояние, когда нормального количества инсулина недостаточно для поддержания нормальной регуляции углеводного обмена. Однако сама по себе инсулинорезистентность не является заболеванием. Чтобы развилось заболевание, необходима комбинация инсулинорезистентности и каких-либо гормонально-метаболических изменений. Частым метаболическим нарушением в период постменопаузы также является значительное повышение постпрандиального уровня глюкозы в сыворотке крови, в то время как уровень глюкозы в крови натощак повышается незначительно. Однако до настоящего времени не полностью выяснено, связано ли какое-либо из этих нарушений углеводного обмена с процессом старения или с увеличением количества общей и висцеральной жировой массы, что типично для пожилых людей, особенно женщин старшей возрастной группы [6-8]. В последние годы отмечена связь инсулинорезистентности с гиперандрогенией. Гиперандрогения, подтвержденная низкими значениями ССГ, является сильным и независимым фактором, повышающим риск развития CД II, гипертензии, болезней сердечно-сосудистой системы и обусловливающим увеличение общей смертности. По данным нашего исследования, все обследуемые женщины имели более низкий уровень ССГ и повышенный уровень свободного Т в сыворотке крови параллельно с инсулинорезистентностью, что согласуется с данными зарубежных исследований [10, 11, 21, 22]. По-нашему мнению, низкие концентрации ССГ и висцеральное ожирение могут оказать дополнительное неблагоприятное действие на инсулинорезистентность. Кроме того, гиперандрогения у женщин в постменопаузе может самостоятельно вызывать инсулинорезистентность, а инсулинорезистентность также может привести к гипер-андрогении за счет продукции андрогенов яичниками и снижения выработки ССГ печенью на фоне гиперинсулинемии. В ходе нашего исследования была выявлена прямая корреляционная зависимость между уровнем Т и показателем HOMA-R, а также обратная зависимость между уровнем ССГ и содержанием Т (чем выше уровень Т, тем ниже уровень ССГ в сыворотке и выше показатель НОМА-R). Висцеральное ожирение напрямую взаимосвязано с состоянием инсулинорезистентности. Висцеральное ожирение представляет собой состояние, при котором интраперитонеальный жир оказывает прямое влияние на печень, изменяя портальное кровообращение, а сама висцеральная жировая ткань является более метаболически активной, чем подкожная жировая клетчатка [16, 17]. При физиологическом старении (особенно в период менопаузы) отмечается увеличение количества висцерального жира, который может оказывать влияние на метаболические процессы вне зависимости от степени выраженности подкожной жировой клетчатки. Прямое поступление свободных жирных кислот, а также других биологически активных субстанций, выделяющихся из жировой ткани в печень, по мнению ряда зарубежных исследователей, и представляет собой один из патогенетических механизмов инсулинорезистентности [21]. Количественно оценить висцеральную жировую ткань можно с помощью магнитно-резонансной томографии или компьютерной томографии, но едва ли эти исследования дадут точную информацию, а использование их в широкой клинической практике затруднительно [16, 17]. Поэтому наиболее приемлемым методом оценки висцеральной жировой ткани является определение объема талии и коэффициента ОТ/ОБ. Увеличение объема талии более 94 см у мужчин и более 74 см у женщин, а также увеличение отношения ОТ/ОБ более 0,88 у женщин и более 1 у мужчин являются одним из критериев висцерального ожирения и ассоциируется с увеличением риска сердечно-сосудистых заболеваний и гипертензии. По данным нашего исследования, о выраженности этого типа ожирения косвенно можно судить анализируя показатели, полученные методом рентгеновской абсорбциометрии. В последнее время большое внимание уделяется нарушениям липидного обмена как основного фактора риска развития атеросклероза у женщин старшей возрастной группы [21]. Тканевая резистентность к инсулинзависимой утилизации глюкозы и инсулиновой супрессии неэстерифицированных жирных кислот (НЭЖК) непосредственно связана с нарушениями липидов и липопротеинов. НЭЖК плазмы являются первичными продуктами липолиза триглицеридов в жировой ткани (рис. 8). Они представляют собой основные субстраты энергетического метаболизма при отсутствии питания, когда уровень инсулина и глюкозы сравнительно низкий. НЭЖК в циркулирующей крови являются основным субстратом для синтеза триглицеридов в печени [21]. Увеличение концентрации инсулина после приема пищи в норме подавляет НЭЖК плазмы крови. Это происходит путем ингибирования гормоночувствительной липазы, а также энзима, отвечающего за липолиз (см. рис. 8). Инсулин также может снижать уровень НЭЖК плазмы, повышая их реэстерификацию в жировой ткани с целью накопления триглицеридов. У больных, резистентных к супрессивному эффекту инсулина на липолиз жировой ткани, уровень НЭЖК повышен. Попытка коррекции возрастной инсулинорезис-тентности является проблемой достаточно новой и дискутабельной. В настоящее время в практике лечения CД II используются препараты, оказывающие терапевтическое воздействие на инсулинорезистентность. К ним относятся бигуаниды и тиазолидиндионы. Метформин (сиофор, фирма «Берлин-Хеми») является эффективным препаратом в коррекции инсулинорезистентности. Его механизм действия связан с усилением поглощения глюкозы скелетными мышцами, подавлением печеночного глюконеогенеза, снижением скорости резорбции глюкозы в тонкой кишке, подавлением аппетита, уменьшением количества висцеральной жировой ткани, что способствует снижению массы тела [1, 21]. К другому классу препаратов, оказывающих воздействие на инсулинорезистентность, относятся тиазолидиндионы. Действие этих препаратов еще недостаточно хорошо изучено. Однако известно, что они не влияют на ИМТ, уровень артериального давления, общий холестерин, а некоторые из них (троглитазон) могут оказывать токсическое влияние на печень.
Гормоночувствительная липаза (ГЧЛ) способствует расщеп-лению триглицеридов адипоцитов в НЭЖК и глицерол. Инсулин ингибирует этот процесс. Использование современных эстроген-гестагенных препаратов для ЗГТ (фемостон, "Солвей-Фарма") у женщин в постменопаузе восполняет физиологический дефицит эстрогенов, снижает уровень Т в сыворотке крови, нивелируя его неблагоприятное воздействие на показатели атерогенности, улучшает показатели липидного спектра и не ухудшает показатели углеводного и жирового обмена. Однако даже раннее начало ЗГТ не оказывает в должной мере терапевтического действия на состояние инсулинорезистентности у женщин в фазе постменопаузы, что согласуется с данными, полученными в ходе нашего исследования (3-я группа). Учитывая, что в ходе выполнения настоящей работы максимальный терапевтический эффект был достигнут в подгруппах женщин, находившихся на терапии спорофором в сочетании с ЗГТ, авторы рекомендуют комбинированное использование антигипергликемических препаратов с целью коррекции физиологической инсулинорезистентности в сочетании с эстроген-гестагенными препаратами для восполнения дефицита эстрогенов у всех женщин как с избыточной, так и с нормальной массой тела, имеющих какие-либо нарушения углеводного обмена. Поэтому перспективные исследования по использованию современных сахарпонижающих препаратов в сочетании с ЗГТ и ранняя верификация диагноза CД II или НТГ у женщин в постменопаузе позволят приблизиться к решению проблемы, связанной с дальнейшим увеличением продолжительности жизни женщин старшего возраста и повышением ее качества. Выводы 1. Постменопауза является инсулинорезистентным состоянием, сопровождающимся базальной гиперинсулинемией, увеличением ИМТ, изменением отношения ОТ/ОБ. У женщин с избыточной массой тела в период постменопаузы возрастает частота возникновения нарушений углеводного обмена (НТГ, CД II). 2. В постменопаузе происходят изменения компо-зиционного состава тела, в частности прогрессирующее увеличение количества висцеральной жировой массы, являющиеся дополнительными факторами увеличения риска развития атеросклероза, ИБС, гиперлипидемии. 3. Коррекция возрастной инсулинорезистентности с использованием метформина (сиофор) в сочетании с ЗГТ эстроген-гестагенными препаратами (фемостон) положительно влияет на показатели углеводного и жирового обмена (снижение уровня HOMA-R, ИРИ, HbA1c%, общего холестерина, ЛПНП, триглицеридов, Т; повышение уровня ССГ, Е2, ЛПВП). 4. У женщин в постменопаузе с нарушениями уг-леводного обмена с целью коррекции и профилактики менопаузального метаболического синдрома рекомендуется использовать эстроген-гестагенные препараты, содержащие в качестве прогестагенового компонента дидрогестерон. О.Р. Григорян, Т.О. Чернова, М.Б. Анциферов Эндокринологический научный центр РАМН, Москва Литература 1. Анциферов М.Б. Исследование UKPDS и его значение в лечении сахарного диабета II типа. Сахарный диабет 1999; 4: 23-27. 2. Дедов И.И., Григорян О.Р., Чернова Т.О., Анциферов М.Б. Заместительная гормональная терапия у женщин, больных сахарным диабетом II типа в климактерии: Практическое руководство. М: Центркнига 1999. 3. Accili D., Drago J., Lee E. et al. Early neonatal death in mice homozygous for a null allele of the insulin receptor gene. Nat Genet 1996; 12: 106-109. 4. Andres R. Principles of geriatric medicine. New York: McGraw-Hill 1985; 311. 5. Banks D., Fossel M. Telomeres, cancer, and aging. Altering the human life span. JAMA 1997; 278: 1345-1348. 6. Barzilai N., Hawkins M. The Pathophysiology of Diabetes in Aging. In: Diabetes Mellitus in the Elderly (ed: James W. Cooper). By the Haworth Press/Inc 1999; 5-20. 7. Borkan G.A., Hults D.E., Gerzof S.G. et al. Age changes in body composition revealed by computed tomography. J Gerontol 1983; 38: 673-677. 8. Davidson M.B. The effect of aging on carbohydrate metabolism: a review of the english literature and a practical approach to the diagnosis of diabetes mellitus in the elderly. Metabolism 1979; 28: 688-705. 9. Despres J.P., Lamarche B., Mauriege P. et al. Hyperinsulinemia as an independent risk factor for ischemic hearst disease.N Engl J Med 1996; 334: 952-7. 10. Enzi G., Gasparo M., Binodetti P.R. et al. subcutaneous and visceral fat distribution according to sex, age and overweight, evaluated by computed tomography. Am J Clin Nutr 1986; 44: 739-746. 11. Folsom A.R., Kaye S.A. Central adiposity and increased risk of coronary artery disease mortality in older women. Epidemiology 1993; 3: 35-41. 12. Fraze E., Chiou M., Chen Y., Raeven G.M. Age related changes in postprandial plasma glucose, insulin and FFA concentrations in non-diabetic individuals. J Am Geriatr Soc 1987; 35: 224-228. 13. Goldberg A.P., Andres R., Bierman E.L. Diabetes mellitus in the elderly. In: Andres R., Bierman E.L., Hazzard W.R. eds. Principles of geriatric medicine. New York: McGraw-Hill 1985; 311. 14. Jackson R.A., Hawa M.I., Roshania R.D. et al. Influence of aging on hepatic and peripheral glucose metabolism in human. Diabetes 1988; 37: 119-129. 15. Lamberts S., van den Beld A., van der Lely A. The endocrinology of aging. Science 1997; 278: 419-424. 16. Larson B. Regional obesity as a health hazard in men-prospective studies. Acta Med Scan 1992; 723: suppl: 45-51. 17. Lebovitz H. Pathogenesis of Type 2 Diabetes. Drug Benefit Trends 2000; 12 2: 8-16. 18. Modan M., Haikin H., Lusky A. et al. Hyperinsulinemia a link between hypertension, obesity and glucose tolerance. J Clin Invest 1985; 75: 809-817. 19. Reaven G.M., Raeven E.P. Age, glucose intolerance, and non-insulin-dependant diabetes mellitus. J Am Geriatr Soc 1985; 33: 286-290. 20. Reaven G.M. (Banting) Role of insulin resistance in human disease. Diabetes 1988; 37: 1595-1607. 21. Reaven G.M., Laws A. Insulin Resistance. The Metabolic Syndrome X. Humana Press 1999. 22. Shimokata H., Tobin J.D., Muller D.C. et al. Studies in the distribution of body fat: 1. effects of age, sex and obesity. J Ge-rontol 1989; 44: 66-73. 23. Weingard D.L., Sinsheimer P., Barett-Connor E.L., McPhi-lip J.B. Community-based study of prevalence of NIDDM in older adults. Diab Care 1990; 13: (suppl 2): 3-8. Российская ассоциация репродукции человека Президент В.С. Корсак Санкт-Петербург, Менделеевская линия, 3 Институт акушерства и гинекологии им. Д.О. Отта Центр "Эко" тел.: (812) 328-2251 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||