Первый опыт использования ингибитора ароматазы анастрозола в программе ЭКО при лечении бесплодия.
|
Известно, что при тяжелом перитонеальном эндометриозе эффективность ЭКО при применении длинного протокола стимуляции суперовуляции с использованием агонистов гонадотропин-рилизинг-гормона (а-ГнРГ) оказывается низкой [4, 7, 8]. Одной из вероятных причин этого может быть отсутствие выраженного подавления продукции эстрадиола (Е2) в период десенситизации гипофиза с помощью препаратов а-ГнРГ.
При тяжелом перитонеальном эндометриозе повышенная базальная концентрация эстрогенов как в естественных условиях, так и в лечебных циклах на фоне действия препаратов а-ГнРГ, используемых в "длинных" схемах стимуляции суперовуляции, может быть связана с тем, что эндометриоидные имплантаты обладают (в отличие от нормального эндометрия) повышенной ароматазной активностью [1, 3]. Ароматаза является ферментом, способствующим образованию эстрогенов из андрогенов [9]. При этом ее активность в очагах эндометриоза в ряде случаев может и не снижаться при дефиците ФСГ на фоне применения а-ГнРГ [1, 3]. Это во многом связано с тем, что помимо ФСГ-зависимого существуют и другие механизмы активации ароматазы, в частности связанные с усилением эффектов простагландинов Е2, образующихся в повышенных концентрациях в очагах воспаления в области эндометриоидных гетеротопий [6]. Поскольку в эндометриоидных имплантатах продукция эстрогенов в определенной степени носит автономный характер и недостаточно снижается при уменьшении уровня ФСГ, то это предположительно может негативно отражаться на ранних этапах фолликулогенеза, происходящего в норме в период минимальной продукции Е2 и ФСГ. Такие отклонения возможно могут способствовать ухудшению качества созревающих ооцитов, что собственно и обусловливает снижение эффективности ЭКО. Сказанное выше привело нас к предположению о возможной полезности дополнительного включения ингибиторов ароматазы в стандартный длинный протокол стимуляции суперовуляции при использовании ЭКО у пациенток с перитонеальным эндометриозом III-IV степени на этапе применения а-ГнРГ до момента назначения гонадотропинов. Следует напомнить, что достоинство ингибиторов ароматазы типа анастрозола и его аналогов состоит в том, что они оказывают прямое супрессивное воздействие на ароматазу и тем самым нивелируют эффекты любых известных механизмов, повышающих активность этого фермента, усиливающего образование эстрогенов [5]. При этом особое значение имеет тот факт, что ингибиторы ароматазы способны гарантированно подавлять и простагландин Е2 и способствовать активации ароматазной активности, весьма характерной для эндометриоидных имплантатов, всегда ассоциирующихся с локальным воспалительным процессом, в особенности при тяжелом течении заболевания [2, 3]. Таким образом, теоретическое обоснование целесообразности использования ингибиторов ароматазы при тяжелом эндометриозе, по нашему мнению, состоит в том, что они в комбинации с а-ГнРГ вполне вероятно должны более эффективно обеспечивать на этапе десенситиза ции гипофиза снижение уровня Е2 до минимальных значений, характерных для первой половины фолликулярной фазы. Таким путем могут быть созданы условия для нормализации ранних этапов фолликулогенеза, проходящих, как известно, в условиях минимальной продукции эстрогенов и ФСГ. Это, в свою очередь, позволило бы рассчитывать на улучшение качества созревающих ооцитов и, как следствие, получаемых эмбрионов. Последнее весьма вероятно могло бы способствовать повышению частоты имплантации переносимых эмбрионов, что в конечном итоге повысило бы эффективность программ ЭКО у больных с тяжелым перитонеальным эндометриозом в целом. Целью настоящего исследования явилась оценка целесообразности дополнения у больных с перитонеальным эндометриозом III-IV степени стандартного длинного протокола (СДП) стимуляции суперовуляции в программе ЭКО препаратами, блокирующими синтез эстрогенов (ингибиторами ароматазы), на этапе индуцируемой а-ГнРГ десенситизации гипофиза до начала использования гонадотропинов. Данный вариант применения СДП в комбинации с ингибиторами ароматазы в дальнейшем обозначается нами как модифицированный длинный протокол (МДП) стимуляции суперовуляции. Материал и методы В исследование отбирались больные в возрасте до 35 лет с бесплодием, обусловленным перитонеальной формой эндометриоза, без признаков какой-либо другой патологии как причины инфертильности. В соответствии с этими критериями было отобрано 86 пациенток, в том числе 35 с I-II и у 51 - с III-IV степенью перитонеального эндометриоза, установленной при лапароскопии, направленной на восстановление естественной фертильности и оказавшейся неэффективной. Все больные были разделены на три группы с учетом степени выраженности эндометриоза и планируемого применения различных протоколов стимуляции суперовуляции: - группа А - 35 женщин с перитонеальным эндометриозом I-II степени. Для индукции суперовуляции в этой группе использовался СДП с применением а-ГнРГ (декапептил-депо, золадекс) и гонадотропинов (метродин, чМГ); - группа Б - 28 женщин с перитонеальным эндометриозом III-IV степени. Индукция суперовуляции в данной группе осуществлялась так же, как и в группе А, т.е. с применением СДП; - группа В - 23 женщины с перитонеальным эндометриозом III-IV степени. При индукции суперовуляции у больных этой группы использовался МДП с применением ингибитора ароматазы анастрозола (коммерческое название аримедекс, производитель "Zeneca Pharmaceuticals", Великобритания), назначавшегося per os в дозе 1 мг/сут с 21-го дня предыдущего цикла до начала использования гонадотропинов (3-5-й день цикла). Средний возраст пациенток в группе А составлял 30,2±2,6 года, в группе Б - 31,4±2,4 года, в группе В - 32,5±2,3 года, средняя продолжительность бесплодия - соответственно 5,5±2,8, 6,4±2,5 и 6,0±2,4 года. Продолжительность периода между окончанием предшествовавшего неэффективного лечения, направленного на восстановление естественной фертильности, и последующим применением ЭКО (в данном исследовании) у всех больных составляла не менее 2 лет. После осуществления контролируемой суперовуляции с применением СДП (в группах А и Б) или МДП (в группе В) последующие этапы процедуры ЭКО у пациенток всех трех групп проводились стандартно по методике, используемой в нашем центре. Эффективность ЭКО оценивалась по показателю частоты маточных беременностей на общее число стимулированных циклов и осуществленных переносов эмбрионов (ЧНБСЦ и ЧНБПЭ). Во всех трех группах дополнительно определялись показатели базального уровня Е2 и ФСГ, а также концентрация этих же гормонов в момент начала использования препаратов чМГ на фоне осуществляемой десенситизации гипофиза (3-5-й день лечебного цикла). Результаты и обсуждение В результате использования МДП в программе ЭКО у больных с перитонеальным эндометриозом III-IV степени (у 23 пациенток группы В) было зарегистрировано 5 клинических беременностей на 23 стимулированных цикла и 21 осуществленный перенос эмбрионов - ЧНБСЦ=21,7%, ЧНБПЭ=23,8% (табл. 1). При применении СДП у больных с той же степенью перитонеального эндометриоза (28 пациенток группы Б) была зарегистрирована всего лишь 1 клиническая беременность, что при расчете показателей ЧНБСЦ и ЧНБПЭ составило соответственно 3,6 и 4,3%. Использование СДП у больных перитонеальным эндометриозом I-II степени (35 пациенток группы А) позволило обеспечить достижение беременности у 10 женщин - ЧНБСЦ = 28,6% и ЧНБПЭ= 29,4%. Таблица 1. Эффективность ЭКО у больных с перитонеальным эндометриозом при использовании СДП и МДП
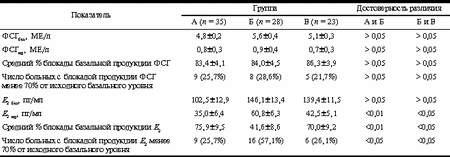
* - достоверность различий показателей между группами А и Б, Б и В - p < 0,05. Таким образом, полученные данные показали: 1) в сопоставлении с больными с перитонеальным эндометриозом I-II степени у пациенток с более тяжелым течением данного заболевания (III-IV cтепень) при применении СДП отмечается статистически значимое снижение показателей ЧНБСЦ и ЧНБПЭ (р<0,05); 2) применение МДП с анастрозолом вместо СДП позволяет достоверно (р<0,05) улучшить показатель ЧНБПЭ у больных с перитонеальным эндометриозом III-IV степени. Результаты гормональных исследований приведены в табл. 2. Базальный уровень ФСГ во всех трех обследуемых группах сопоставим (р>0,05), и это говорит о том, что утяжеление течения перитонеального эндометриоза (группы Б и В) фактически не отражается на базальной продукции ФСГ, оказывающейся такой же, как и у пациенток с более легким течением заболевания (группа А). Базальный уровень Е2 у больных с эндометриозом III-IV степени (группы Б и В) также достоверно не отличался от уровня Е2 у пациенток с эндометриозом I-II степени (группа А), хотя в среднем и был несколько более высоким именно у больных с более тяжелым течением заболевания. Таблица 2. Гормональные показатели у пациенток с перитонеальным эндометриозом при использовании СДП и МДП
Примечание. ФСГбаз и Е2 баз - базальные сывороточные концентрации ФСГ и Е2; ФСГПД и Е2 ПД - сывороточные концентрации ФСГ и Е2 в период десенситизации гипофиза (на 10-12-е сутки после начала использования препаратов а-ГнРГ). Применение препаратов а-ГнРГ как в стандартном протоколе (у больных групп А и Б), так и в его модифицированном варианте (у больных группы В) обусловливало на 10-12-е сутки после начала их использования блокаду продукции ФСГ в среднем на 80-90% от исходного базального уровня у большинства пациенток, причем значения этого показателя во всех трех группах статистически значимо не различались (р>0,05). Следует особо отметить, что во всех трех группах были пациентки, у которых а-ГнРГ-обусловленная блокада продукции ФСГ составляла менее 70% от исходного уровня, т.е. была выражена недостаточно или даже отсутствовала вообще. Число таких больных в группах А, Б и В статистически значимо не различалось и соответственно составляло 25,7, 28,6 и 21,7%. Эти данные позволяют заключить следующее: 1) препараты а-ГнРГ обеспечивают в большинстве случаев эффективную десенситизацию гипофиза (блокаду продукции ФСГ) у больных как с I-II, так и с III-IV степенью перитонеального эндометриоза, т.е. утяжеление течения заболевания не влияет на способность этих препаратов подавлять образование ФСГ. Сочетанное использование препаратов а-ГнРГ и ингибиторов ароматазы не оказывает какого-либо влияния на частоту и степень выраженности а-ГнРГ-обусловленного эффекта десенситизации гипофиза; 2) у 20-30% больных с перитонеальным эндометриозом не обнаруживается достаточной выраженности десенситизирующего эффекта а-ГнРГ (по критерию подавления образования ФСГ), причем данное явление не зависит от степени выраженности заболевания. Это доказывается отсутствием статистически значимой разницы между числом пациенток в группах А и Б, резистентных к десенситизирующему эффекту а-ГнРГ. Вполне очевидно, что на описываемое явление не влияет и дополнение лечения ингибиторами ароматазы, так как число пациенток с недостаточно выраженным десенситизирующим эффектом а-ГнРГ в группах Б и В также статистически не различалось. Если степень выраженности перитонеального эндометриоза фактически не влияла на а-ГнРГ-обусловленное подавление продукции ФСГ, то при оценке влияния этих препаратов на продукцию Е2 были получены совершенно иные данные (см. табл. 2): у больных с перитонеальным эндометриозом III-IV степени (группа Б) на 10-12-е сутки применения а-ГнРГ уровень Е2 снижался до 60,8±6,3 пг/мл (средний процент блокады продукции Е2 в сравнении с его базальным уровнем 41,6±8,6). У больных же с перитонеальным эндометриозом I-II степени (группа А) сходное использование а-ГнРГ обусловливало снижение уровня Е2 до 35,0±6,4 пг/мл (средний процент блокады продукции Е2 в сравнении с его базальным уровнем 75,9±9,5). Следует подчеркнуть, что различия между группами А и Б по обоим показателям, характеризующим подавление продукции Е2 на фоне применения а-ГнРГ, статистически значимы (р<0,01). К этому можно добавить, что в группе Б в сравнении с группой А выявлялось и достоверно (р<0,05) большее число больных (57,1% против 25,7%), у которых использование а-ГнРГ сопровождалось недостаточно выраженной (менее 70% от исходного базального уровня) блокадой продукции Е2. Таким образом, полученные данные показывают, что утяжеление течения эндометриоза ослабляет, а в некоторых случаях почти нивелирует эффект а-ГнРГ, обусловливающий снижение продукции Е2, хотя при этом и отмечается выраженная блокада образования ФСГ. Это означает, что у значительного числа больных с тяжелым перитонеальным эндометриозом активность продукции Е2 носит автономный характер (не зависящий от колебаний уровня ФСГ), и поэтому недостаточно выраженно снижается на фоне блокады продукции ФСГ, обусловливаемой применением а-ГнРГ. Использование у больных с тяжелым эндометриозом ингибиторов ароматазы в комбинации с а-ГнРГ в группе В сопровождалось достоверно большим, чем в группе Б, снижением продукции Е2 на 10-12-е сутки после начала их применения. Так, в группах В и Б к моменту начала применения гонадотропинов на 3-5-е сутки лечебного цикла концентрация Е2 составляла соответственно 42,5±5,1 и 60,8±6,3 пг/мл (р<0,05), показатель среднего процента блокады исходного базального уровня Е2 равнялся 70,0±9,2 и 41,6±8,6 (р<0,05). Сопоставление данных гормональных исследований (см. табл. 2) с конечными результатами ЭКО (см. табл. 1) в группах А и Б показывает, что утяжеление течения перитонеального эндометриоза, сопровождаемое резким снижением ЧНБСЦ и ЧНБПЭ, отмечается на фоне достоверного снижения способности а-ГнРГ подавлять продукцию Е2, но не ФСГ. Отсутствие выраженного подавления образования Е2 на фоне уменьшения продукции ФСГ возможно объясняет снижение эффективности ЭКО при применении протоколов стимуляции суперовуляции с а-ГнРГ и гонадотропинами у больных с более тяжелыми проявлениями эндометриоза. Причину недостаточной выраженности подавления продукции Е2 при снижении уровня ФСГ на фоне действия а-ГнРГ в лечебных циклах ЭКО, как уже отмечалось, можно связать с их "автономной" (мало зависящей от колебаний уровня ФСГ) продукцией в эндометриоидных имплантатах [1-3, 9]. Таким образом, проведенные гормональные исследования в группах А и Б наглядно продемонстрировали существование при утяжелении перитонеального эндометриоза достаточно активной "автономной" (ФСГ-независимой) продукции Е2, негативно отражающейся на конечных результатах ЭКО при использовании стандартного длинного протокола стимуляции суперовуляции. Результаты, полученные в группе В, позволили установить, что при сочетанном использовании а-ГнРГ и анастрозола у пациенток с эндометриозом III-IV степени эффективность ЭКО оказывается достоверно более высокой, чем у больных с аналогичным проявлением заболевания, стимуляция суперовуляции у которых осуществлялась с применением СДП (группа Б). У пациенток группы В показатели ЧНБСЦ и ЧНБПЭ фактически восстанавливались до уровня, регистрируемого у больных с более легким течением заболевания (группа А). Гормональные исследования у больных группы В показали, что дополнение лечения анастрозолом обеспечивает подавление базальной продукции Е2 до значений, сопоставимых с показателями, рассчитанными в группе А. Эти результаты собственно и объясняют механизм, обеспечивающий улучшение результатов ЭКО при тяжелом перитонеальном эндометриозе у больных, получавших лечение, дополняемое ингибиторами ароматазы на этапе а-ГнРГ-индуцируемой десенситизации гипофиза. Представленные данные фактически являются обоснованием целесообразности использования описанного модифицированного протокола стимуляции суперовуляции с применением ингибиторов ароматазы в программах ЭКО у всех больных с перитонеальным эндометриозом III-IV степени. К.В. Краснопольская, А.С. Калугина Кафедра акушерства и гинекологии педиатрического факультета Российского государственного университета, Центр планирования семьи и репродукции, Москва Литература 1. Bulin S.E., Zeitoun K.M., Takayama K. et. al. Estrogen production in endometriosis and use of aromatase inhibitors to treat endometriosis. Endocrine-Related Cancer 1999; 6: 293-301. 2. Вulin S.E., Zeitoun K.M., Sasano H. Molecular basis for treating endometriosis with aromatase inhibitors. Hum Reprod Update 2000; Sep 6(5): 413-418. 3. Bulin S.E., Zeitoun K.M., Takayama I. et al. Aromatase as a therapeutic target in endometriosis. Trends Endocrinol Metab 2000; 11(1): 22-27. 4. Debit T.S., Al-Taher M., Al-Sarraf M. et al. The significance of endometriosis on the outcome of in vitro fertilization. Hum Reprod 1999; 14: Abstract Book 1, R-141: 342. 5. Johnston J.O. Aromatase inhibitors. Crit Rev Biochem Mol Biol 1998; 33(5): 375-405. 6. Noble L.S., Takayama K., Putman J.M. et al. Prostaglandin E2 stimulates aromatase expression in endometriosis-derived stromal cells. J Clin Endocrinol Metab 1997; 82: 600-606. 7. Pagidas R., Falcone T., Hemmings R. et al. Comparison of reoperation for moderate (stage III) and severe (stage IV) endometriosis related infertility with in vitro fertilisation-embrio transfer. Fertil Steril 1996; 6: 4: 791-795. 8. Ryan I.P., Taylor R.N. Endometriosis and infertility: new concepts. Obstet and Gynecol Survey 1997; 52: 365-371. 9. Simpson E., Rubin G., Clyne C. et al. Local estrogen biosynthesis in males and females. Endocrine-Related Cancer 1999; 6: 131-137. |