Избыточная масса тела и абдоминальный тип ожирения.
|
Эволюционные исследования, основанные на изучении структуры пролактина (ПРЛ), показали значимость этого гормона у многих видов животных, включая рыб, амфибий и птиц. Хотя название «пролактин» происходит от его роли в лактации, ему принадлежит более 80 различных биологических действий, более 300 биологических функций [20]. Известно, что ПРЛ обладает большим спектром действий, чем все остальные гипофизарные гормоны в совокупности [14]. ПРЛ участвует в регуляции водно-солевого обмена, иммунного ответа, оказывает выраженное влияние на поведенческие реакции животных [6].
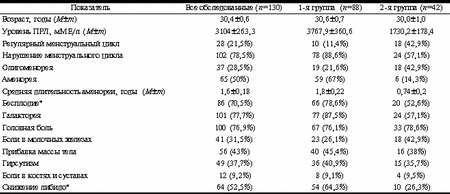
Действие ПРЛ обусловлено его связыванием со специфическими рецепторами, представленными во многих органах и тканях - ЦНС, репродуктивной системе, молочной железе, надпочечниках, почках, печени, эпителии желудка и кишечника, иммунных клетках, костной ткани и др. [4, 11, 13, 19, 21, 22, 25]. Разнообразное биологическое действие ПРЛ особенно ярко проявляется при гиперпролактиновых состояниях, так как наряду с гипофункцией яичников могут возникать множественные изменения функций различных органов и систем и некоторых метаболических процессов. С учетом регулирующего влияния многих периферических гормонов на секрецию ПРЛ, роли жировой ткани в метаболизме гормонов, а также регуляторного влияния некоторых гормонов и нейропептидов как на секрецию ПРЛ, так и жировой обмен (инсулин, галанин, эндогенные опиоидные пептиды) представляется значимым изучение жирового обмена у пациенток с гиперпролактинемией (ГП). Если в ранних описаниях гиперпролактинемических состояний подчеркивалось истощение больных на фоне обильной галактореи (так называемая "молочная сухотка"), то в современных условиях, напротив, нередко выявляется умеренное ожирение [1]. Данные литературы о преобладании конституциональной принадлежности и массоростовых показателей больных с ГП крайне разноречивы [2, 8, 15], поэтому, нам кажется, недооценивается роль ожирения при ГП. Одни авторы отмечают различную степень ожирения у 50-60% пациенток [2], повышение уровня ПРЛ у женщин с прибавкой массы тела в течение последнего года [15], в то время как другие исследователи отрицают взаимосвязь повышения массы тела и ГП [3]. Представляется важным изучение влияния ГП и ее терапии на массу тела пациенток. Целью исследования явилась оценка состояния индекса массы тела (ИМТ) и типа ожирения, а также влияния терапии парлоделом, норпролаком и достинексом у пациенток с опухолевым и неопухолевым генезом ГП. Материал и методы Группу исследования составили 130 женщин репродуктивного возраста (18-45 лет) с патологической ГП и уровнем ПРЛ > 800 мМЕ/л не менее чем в двух определениях. Критериями исключения из исследования явились нарушения функции щитовидной железы, коры надпочечников, почечная и печеночная недостаточность, алкогольная и наркотическая зависимость, отказ от предохранения от беременности барьерными методами в ходе лечения. В зависимости от наличия пролактиномы гипофиза пациенток разделили на 2 клинические группы: в 1-ю группу вошли 88 женщин с пролактиномами гипофиза, во 2-ю - 42 с ГП неопухолевого генеза. Пациентки каждой клинической группы были разделены на 3 подгруппы по получаемому препарату (подгруппы сопостави мы по возрасту, антропометрическим данным и гинекологическому анамнезу). В 1-й клинической группе подгруппы парлодел (бромокриптин) получали 33 больных, норпролак (квинаголид) - 19, достинекс (каберголин) - 36. Во 2-й группе было по 14 больных в каждой подгруппе. Методы обследования включали общеклинические, гормональное (ПРЛ, ЛГ, ФСГ, ТТГ, Т3, Т4, ДГА, П, Е2) исследования, УЗИ органов малого таза и молочных желез, магнитно-резо нансную томографию (МРТ) гипофиза, ДЭРА, исследование липидного спектра крови [общий холестерин (ХС), ХС липопротеинов низкой плотности (ЛПНП), ХС липопротеинов очень низкой плотности (ЛПОНП), ХС липопротеинов высокой плотности (ЛПВП), триглицериды (ТГ), апо АI и апо В, коэффициент апоВ/АI], измерение ИМТ. Уровень гормонов определяли методом иммуноферментного анализа (ИФА) с помощью соответствующих тест-систем на автоматическом анализаторе "Cobas Core II". Содержание общего ХС, ХС ЛПВП, ТГ в сыворотке крови определяли на автоанализаторе "Airone 200" ферментным методом с помощью комбинированных диагностических наборов фирмы "Human", содержание апоAI и апоB в сыворотке крови - методом иммунонефелометрии на автоанализаторе "Behring". У всех 130 пациенток определяли индекс массы тела Кетле; анализ полученных данных проводили на основании классификации Международной группы экспертов по ожирению (International Obesity Task) [24]. Для определения типа ожирения использовали индекс отношения окружности талии к окружности бедер (ОТ/ОБ), а также показатель окружности талии (ОТ). Критерием абдоминального, или центрального типа ожирения считался индекс ОТ/ОБ > 0,8 либо ОТ > 80 см. Длительность курса терапии составила 6 мес, курс последующего наблюдения - также 6 мес. Дозы препаратов подбирали индивидуально в соответствии с ежемесячными показателями уровня ПРЛ. Парлодел (фирма "Сандоз", Швейцария) использовали в дозах от 2,5 до 12,5 мг/сут, норпролак (фирма "Сандоз", Швейцария) - в дозах 75-300 мкг/сут, достинекс 0,5 мг (фирма "Фармация-Апджон", США) - в дозах 0,125-2 мг/нед. Условием приема достинекса являлосьпредохранение от беременности в течение всего курса приема (6 мес) и на протяжении 1 мес после окончания терапии. Статистический анализ данных выполнен при помощи пакета статистических программ "Statistica", разработанного "StatSoft Inc", (США). Результаты исследования По данным МРТ, микропролактиномы выявлены у 74 пациенток, макропролактиномы - у 14, синдром "пустого" турецкого седла - у 7. У 10 больных выявлен синдром поликистозных яичников, 25 имели идиопатическую форму заболевания. Уровень ПРЛ в среднем составил 3104±263,3 мМЕ/л, в 1-й группе - 3767,9±360,6 мМЕ/л, во 2-й группе - 1730,2±178,4 мМЕ/л. В клинической картине заболевания доминировали нарушения в репродуктивной системе (табл. 1). Прибавку массы тела отметили 56 (43%) пациенток, в среднем она составила 10,4±1,0 кг. В большинстве случаев повышение массы тела было постепенным и отмечено через 1-2 года после начала заболевания. В 1-й группе прибавка массы тела определена у 45,4% пациенток, причем у больных с макропролактиномами несколько чаще, чем у больных с микропролактиномами гипофиза (57,1 и 43,2% соответственно; p > 0,05). Результаты проведенного нами обследования позволили выявить избыточную массу тела у 50% женщин, при этом у пациенток с ГП опухолевого генеза она отмечена чаще (52,3%), чем у пациенток с неопухолевым генезом (35,7%). ИМТ, равный 18-24,9 (в среднем 20,7±0,55) и соответствующий нормальной массе тела, определен у 65 (50%) из 130 пациенток. Степень I избыточного ожирения (ИМТ 25-29,9, в среднем 27,3±0,2) выявлена у 47 (36,1%) из 130 пациенток. Степень IIа ожирения (ИМТ 30-34,9, в среднем 32,0±0,5) обнаружена у 13 (10%) пациенток. У 1 женщины ИМТ соответствовал морбидному ожирению и составлял 46,9. Пациентки с избыточной массой тела достоверно чаще встречались в 1-й группе в сравнении со 2-й группой (52,3 и 35,7% соответственно, p < 0,05). Аналогичная тенденция по основным показателям сохранялась и по степеням ожирения. Степень I избыточной массы тела отмечена у 35 (39,7%) пациенток 1-й группы и у 12 (28,5%) пациенток 2-й группы (p > 0,05), IIa степень ожирения - соответственно у 10 (11,4%) и 3 (7,1%) (p > 0,05). Морбидное ожирение выявлено у женщины 42 лет с опухолевым генезом ГП и с массой тела 136 кг. При анализе типа ожирения у пациенток с избыточной массой тела (ИМТ > 25) центральный тип ожирения выявлен у 43 (66,2%) из 65 пациенток, причем частота центрального типа ожирения была достоверно выше в 1-й группе - 84,6% (33 из 39 больных) в сравнении с 38,5% (10 из 26 пациенток) во 2-й группе (p < 0,05). Таблица 1. Клинико-лабораторная характеристика пациенток с ГП
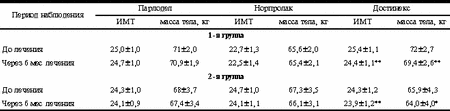
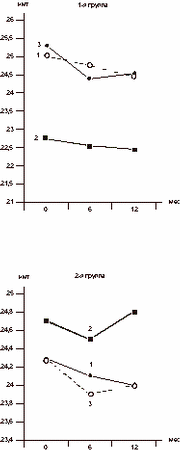
Примечание. * - из анализа исключены virgo intacta. У 8 (88,9%) из 9 пациенток с макропролактиномой гипофиза и ИМТ > 25 отмечался центральный тип ожирения. У больных с микропролактиномой гипофиза частота выявления абдоминального типа ожирения достоверно ниже - 64,1% (25 из 39 пациенток), но достоверно выше, чем у пациенток 2-й группы (p < 0,05). Таким образом, полученные данные распределения жировой ткани свидетельствуют о преобладании у пациенток с ГП и избыточной массой тела так называемого центрального типа ожирения. Достоверно более высокая частота абдоминального типа ожирения отмечена у пациенток с пролактиномами гипофиза, максимально высокая - в группе пациенток с макропролактиномами гипофиза. Корреляционный анализ позволил установить прямую зависимость между ИМТ и уровнем ТГ (r=0,44, p < 0,05), ИМТ и уровнем апоВ/апоА (r=0,63, p < 0,05). Выявлена также обратная зависимость ИМТ и уровня ХС ЛПВП (r=-0,5, p < 0,05). Корреляции между уровнем общего ХС и ИМТ не обнаружено. Отсутствие корреляции подтверждено и результатами индивидуального анализа; так, повышенные значения общего ХС обнаружены у 61,9% (у 13 из 21) пациенток с нормальным ИМТ и у 52,2% (у 12 из 23) - с повышенным ИМТ, что может свидетельствовать о различных механизмах развития данных нарушений. В ходе исследования на фоне проводимой терапии различными агонистами дофамина отмечено значительное снижение уровня ПРЛ, при этом выявлена достоверно более высокая эффективность агониста дофамина III поколения - достинекса. Так, через 6 мес лечения нормализация уровня ПРЛ при приеме достинекса, парлодела и норпролака составила у пациенток с пролактиномами гипофиза 94,4, 63,6, 63,2% соответственно, а у пациенток с неопухолевым генезом заболевания - 100, 78,6, 85,7% соответственно. При этом к концу курса терапии средний уровень ПРЛ у пациенток с пролактиномами гипофиза составил: при лечении достинексом 276,9±42,2 мМЕ/л, норпролаком 746,2±179,9 мМЕ/л, парлоделом 631,8±157,4 мМЕ/л. У пациенток с неопухолевым генезом ГП средний уровень ПРЛ составил при лечении парлоделом 229±34,6 мМЕ/л, норпролаком 349,4±73,4 мМЕ/л, достинексом 163,3±42,9 мМЕ/л. Результаты измерения ИМТ, проводимые в ходе исследования, показали достоверное снижение массы тела и ИМТ на фоне приема достинекса, в то время как у пациенток, получавших норпролак и парлодел, определяется тенденция к снижению данных показателей (табл. 2). Статистически значимое снижение значений ИМТ и массы тела на фоне лечения (через 6 мес лечения достинексом) и после его отмены (через 6 мес после окончания терапии) выявлено у пациенток как с опухолевым, так и с неопухолевым генезом ГП (см. рисунок). При анализе изменений этих показателей у пациенток с избыточной массой тела (ИМТ > 25) также обнаружено снижение ИМТ и массы тела. Таблица 2. Динамика ИМТ и массы тела у пациенток с ГП на фоне терапии парлоделом, норпролаком, достинексом (M±m)
Примечание. Звездочками отмечена достоверность показателей в сравнении с исходными значениями: * - p < 0,01, ** - p < 0,001. В то же время, по данным M. Ferreira и соавт., у женщин с прибавкой массы (более 5 кг за последний год) при отсутствии изменений в режиме питания, курения или общих эндокринных заболеваний отмечено повышение уровня ПРЛ и чаще выявлялась галакторея [10]. Так, Y. Greenman и соавт. [15] выявили прибавку массы тела на 8-22 кг у 13 из 42 пациенток с пролактиномами гипофиза и только у 1 из 36 пациенток с нефункционирующей аденомой гипофиза. Эти данные коррелируют с полученными нами результатами, подтверждают преимущественное ожирение у пациенток с пролактинсекретирующими опухолями гипофиза. Возможные механизмы развития ожирения у пациенток с ГП остаются неизвестными. Важной вехой послужило открытие в 1994 г. гена ожирения, кодирующего выработку лептина - гормона, продуцируемого жировыми клетками и оказывающего влияние на регуляцию процесса потребления пищи. По данным литературы, существующее взаимодействие между гипоталамо-гипофизарно-яичниковой системой и лептином [5, 7, 9, 12] может служить объяснением развития данного процесса. Весьма вероятна непосредственная роль ПРЛ в возникновении нарушений жирового обмена. Известно, что у некоторых видов животных (у самок крыс и птиц) введение ПРЛ вызывает повышение аппетита и увеличение потребления пищи, что сопровождается отложением жира и прибавкой массы тела и может быть рассмотрено как физиологическое явление, необходимое для вскармливания будущего потомства [17]. Известно, что к веществам, усиливающим аппетит, относятся галанин, эндогенные опиоидные пептиды, которые также считаются и ПРЛ-стимулирующими факторами. Обнаруженная нами по данным ЭЭГ дисрегуляция нейромедиаторных систем головного мозга подтверждает возможность растормаживания центров голода и возникновения обменных нарушений.
Динамика ИМТ у пациенток с ГП на фоне и после окончания терапии парлоделом (1), норпролаком (2), достинексом (3), * p < 0,05. Обсуждение результатов Несмотря на очевидную актуальность данной проблемы, в литературе отсутствуют данные по исследованию преимущественного типа ожирения у пациенток с ГП. Одними исследователями отрицается корреляция между ожирением и ГП [3]. Обращает на себя внимание сходство клинической картины при ГП с состоянием псевдобеременности, что может свидетельствовать об общности триггерных механизмов (активации нейроэндокринных путей) этих явлений, в том числе развития ожирения у обследуемых женщин. Определенным доказательством непосредственной роли повышения уровня ПРЛ в формировании ожирения у данных больных является и полученное нами снижение массы тела на фоне терапии агонистами дофамина, в особенности - достинексом. Если избыточная масса тела у пациенток с ГП отмечена рядом авторов, то данных по изучению типа ожирения в зарубежной и отечественной литературе практически нет. Полученные нами результаты свидетельствуют о высокой частоте (66,2%) центрального типа ожирения у пациенток с ГП и избыточной массой тела. Примечательно, что центральный тип ожирения у пациенток с избыточной массой тела встречался намного чаще у больных с пролактиномами гипофиза (84,6% в сравнении с 38,5% у пациенток с неопухолевым генезом ГП). Полученные данные свидетельствуют о наличии существенных метаболических нарушений у пациенток с ГП и могут иметь важное клиническое значение. Известно, что центральный тип ожирения характеризуется отложением жировой ткани в брыжейке и сальнике. Интенсивный липолиз в жировой ткани абдоминально-висцеральной области приводит к увеличению содержания свободных жирных кислот в системном кровотоке. Вследствие этого возникают характерные для абдоминального ожирения нарушения метаболизма: инсулинорезистентность, повышение уровня глюкозы, инсулина, ХС ЛПОНП и ТГ в крови, что в совокупности приводит к высокому риску развития заболеваний сердечно-сосудистой системы и некоторых метаболических нарушений (снижение толерантности к глюкозе, инсулиннезависимый сахарный диабет II типа). Возникает порочный круг. Сведений литературы по этой проблеме мало. В то же время имеются экспериментальные данные о том, что экзогенное введение ПРЛ крысам вызывает повышенный инсулиновый ответ на внутривенное введение глюкозы. У женщин как с опухолевым, так и неопухолевым генезом ГП выявлена гиперинсулинемия при нормогликемии [16]. У данных пациенток определяются повышенная секреция инсулина и подавление глюкагона в ответ на глюкозо-толерантный тест [23]. Эти явления наблюдаются как у животных, так и у людей и сходны с таковыми в поздние сроки беременности. Полученные в эксперименте данные свидетельствуют о том, что ПРЛ может напрямую стимулировать b-клетки поджелудочной железы и повышать периферическое сопротивление действию инсулина. Взаимосвязь ПРЛ и секреции инсулина подтверждается селективным нахождением иммунореактивного ПРЛ в цитоплазме b-клеток поджелудочной железы [18]. Таким образом, для пациенток с ГП наряду с нарушениями в репродуктивной системе характерны и некоторые метаболические расстройства. У половины больных с ГП выявлена избыточная масса тела. Избыточная масса тела и центральный тип ожирения достоверно чаще отмечены у пациенток с опухолевым генезом ГП (p < 0,05). Применение современного агониста дофамина - достинекса, дающего выраженный пролактинингибирующий эффект, приводит к достоверному уменьшению массы тела и ИМТ у больных с ГП, страдающих ожирением, что, по-видимому, может снижать риск развития некоторых метаболических нарушений и заболеваний сердечно-сосудистой системы. А.А. Осипова, В.П. Сметник Научный центр акушерства, гинекологии и перинатологии РАМН, Москва Литература 1. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. М: Медицина 2000. 2. Марова Е.И., Вакс В.В., Дзеранова Л.К. Гиперпролактинемия у женщин и мужчин: Пособие для врачей. Pharmacia and Upjohn. 3. Овсянникова Т.В. Патогенез, клиника, диагностика и отдаленные результаты лечения бесплодия при гиперпролактинемии у женщин: Дис. ... д-ра мед. наук. М 1990; 316. 4. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология: Руководство. М 1999. 5. Barash I., Cheung C., Weigle D. et al. Leptin is a metabolic signal to the reproductive system. Endocrinology 1996; 137: 3144-3147. 6. Breckwoldt M., Crosignani P. A new treatment Option for Hyperprolactinemic Disorders. XI Ann. Meeting of the European Society of Human Reproduction and Embriology 1995. 7. Campfield A., Smith F., Burn P. The OB protein (Leptin) pathway - A link between adipose tissue mass and central neural networks. Horm Metab Res 1996; 28: 619-632. 8. Chow W., Lam K. An overweight woman with galactorrhoea. Postgrad Med J 1998; 74: (868): 121-122. 9. Evans B., Agar L., Summers R. The role of the sympathetic nervous system in the regulation of leptin synthesis in C57BL/6mice. FEBS Lee 1999; 44: 149-154. 10. Ferreira M., Sobrincho L., Pirs J. et al. Endocrine and psychological evaluation of women with recent weight gain. Psychoneuroendocrinology 1995; 20: 53-63. 11. Freemark M., Driscoll P., Maaskant R. et al. Ontogenesis of prolactin receptors in the human fetus in early gestation. Implications for tissue differetiation and development. J Clin Invest 1997; 99: 1107. 12. Friedman J., Halaas J. Leptin and the regulation of body weight in mammals. Nature 1998; 22: 763-770. 13. Glasow A., Breidert M., Haidan A. et al. Functional aspects of the effect of prolactin (PRL) on adrenal steroidogenesis and distribution of the PRL receptor in the human adrenal gland. J Clin Endocrinol Metab 1996; 81: 3103. 14. Goffin V. et al. From the molecular biology of prolactin and its receptor to the lessons learned from knocout mice models. Genetic Analysis. Biomolecular Engineering 1999; 15: 189-201. 15. Greenman Y., Tordjman K., Stern N. Increased body weight associated with prolactin secreting pituitary adenomas: weight loss with normalization of prolactin levels. Clin Endocrinol Oxford 1998; 48(5): 547-553. 16. Gustafson A., Banasiak M., Kalkhoff R. et al. Prolactin-induced hyperinsulinemia (abstract). Clin Res 1978; 26: 720. 17. Meier A. Temporal synergism of corticosterone and prolactin controlling seasonal conditions in the white throated sparrow, Zonotrichia albicolis. The history of clinical endocrinology. V. Medvei. London: Parthenon Publishing Group 1993. 18. Meuris S., Verloes A., Robyn C. Immunocytochemical localization of prolactin-like immunoreactivity in rat pancreatic islets. Endocrinology 1983; 112: 2221. 19. Nagano M., Chaster E., Choquet A. et al. Expression of prolactin and growth hormone receptor genes and their isoforms in the gastrointestinal tract. Am J Physiоl 1995; 268: 431-432. 20. Nicoll C., Bern H. On the actions of PRL among the vertebrates: is there a common denominator? G. Wolstenholme, J. Knight. Lactogenic Hormone. London: Churchill Livingstone 1972; 299-327. 21. Nigami A., Tominaga T. Effects of prolactin on cultured humanendometrial cells. Horm Res 1991; 35: 50-57. 22. Pelligrini I., Lebrun J., Ali S., Kelli P. Expression of prolactin and its receptor in humanlymphoid cells. Mol Endocrinol 1992; 6: 1023-1031. 23. Tourniare J., Pallo D., Pausset G. et al. Diminution de la tolerance glucidique et hyperinsulinisme dans l'adenome a prolactine. Nou Pres Med 1974; 3: 1705. 24. WHO. Technical Report Series 854. Geneva 1995. 25. Yen S., Jaffe R. Prolactin in human reproduction. Reproductive Endocrinology, Physiology, Pathiphysiology, Clinical Management. 4th Edition. 1999; 257-283. |